Biochemistry
Biochemistry — Structure And Catalysis
by Jiale Zheng
Chapter I -Water
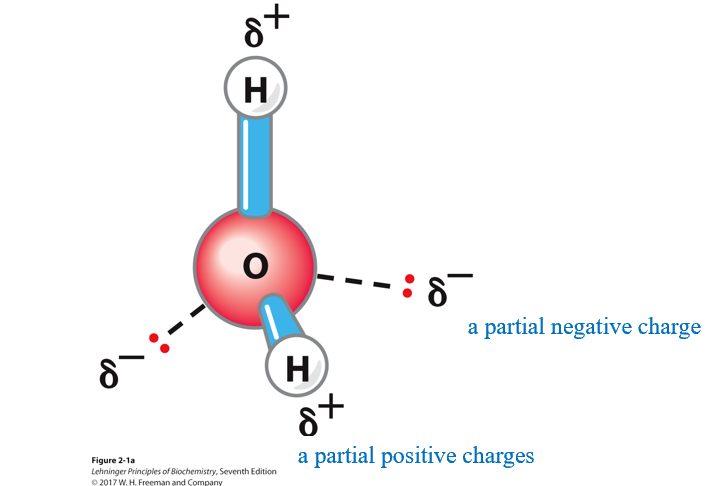
水分子的结构
- $sp^{3}$杂化,扭曲的正四面体结构
- 氢氧电负性差异产生偶极矩
氢键
- 常和N、O等元素形成
- 线性键合模式氢键最强(成键的三个原子线性排列)
水的氢键
- 水能作为H的受体和供体
- 一个水分子至多4个氢键(冰可以达到最多4个,液态水平均3.4个)
- 导致了水的高沸点、高熔点、大表面张力
- 键能低(20kJ/mol),相比之下氢氧键有420kJ/mol
氢键的重要性
- 影响蛋白质、DNA、多糖的结构和功能
- 酶与底物的结合
- 激素与受体的结合
- mRNA与tRNA之间的配对
水作为溶剂
- 水对带电的和极性的分子是良好的溶剂
- 氨基酸、肽、小分子醇、碳水化合物
- 水对非极性分子是不良溶剂
- 非极性气体如$CO_{2}$、芳香性物质、脂肪链
几种非共价作用
离子相互作用(库伦力):
- 作用距离通常不大于40nm
- 实例:盐溶解的过程是破坏离子相互作用(系统能量降低但是熵增)
范德华力(Van der Waals):
- 近距离排斥、远距离吸引
- 具有一个最低能量距离
- 短程力、作用弱、普遍性(存在于任意两个原子之间)
- 注意:分子识别过程中没有范德华力,只存在于折叠的分子内部
- 重要性
- 决定三维结构的互补性
- 稳定生物大分子
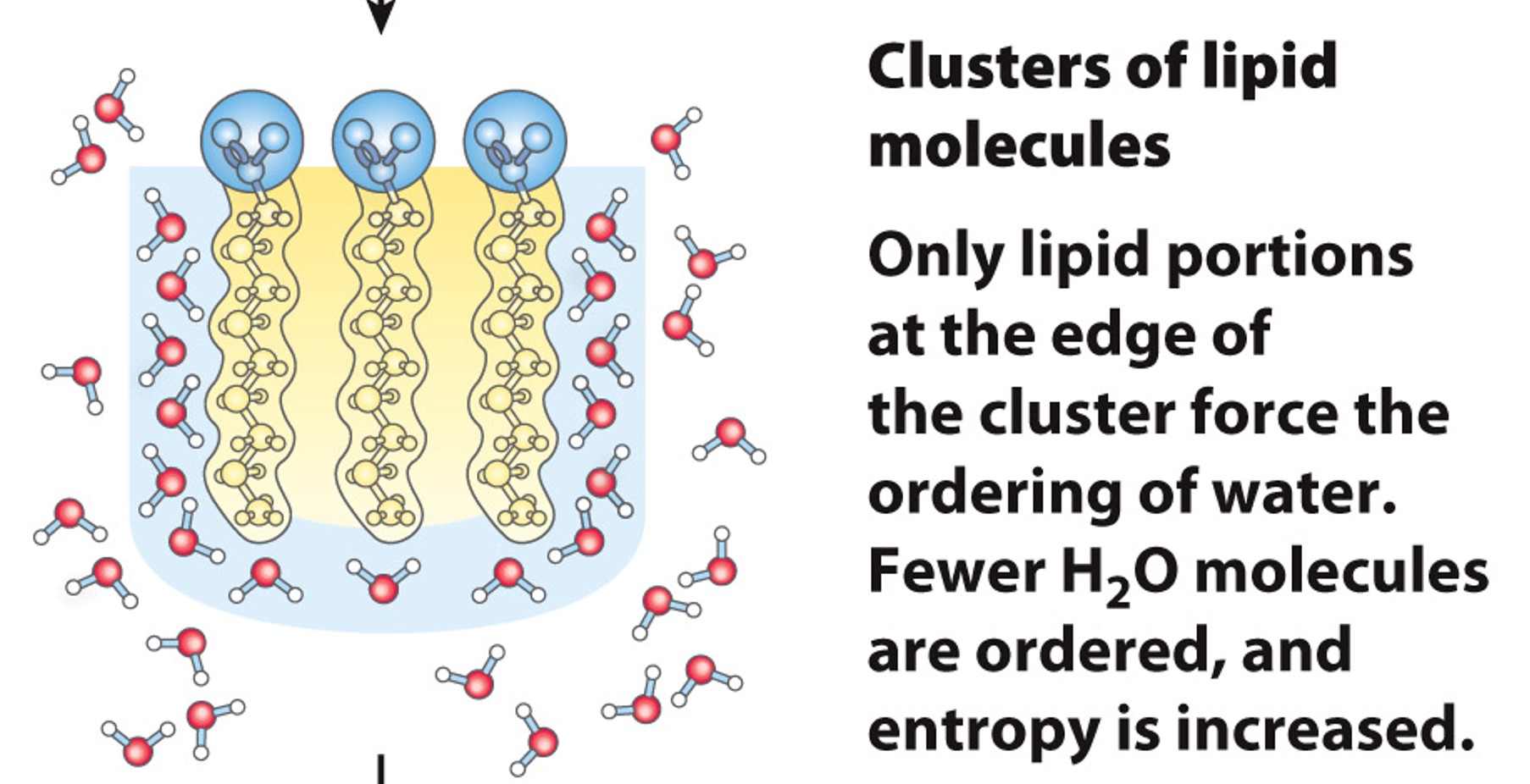
疏水效应(Hydrophobic):
- 非极性分子在水溶液中的相互作用
- 是蛋白质折叠、蛋白质相互作用、激素与受体结合的主要因素
- 酶或者受体的结合部位(Binding sites)通常是疏水的,可以和疏水的物质结合
在水溶液中非极性分子会聚集在一起,最外围形成一层水化膜,使有序排列的水分子最少,从而使系统熵增
浓度足够高的时候可以形成一个脂质球
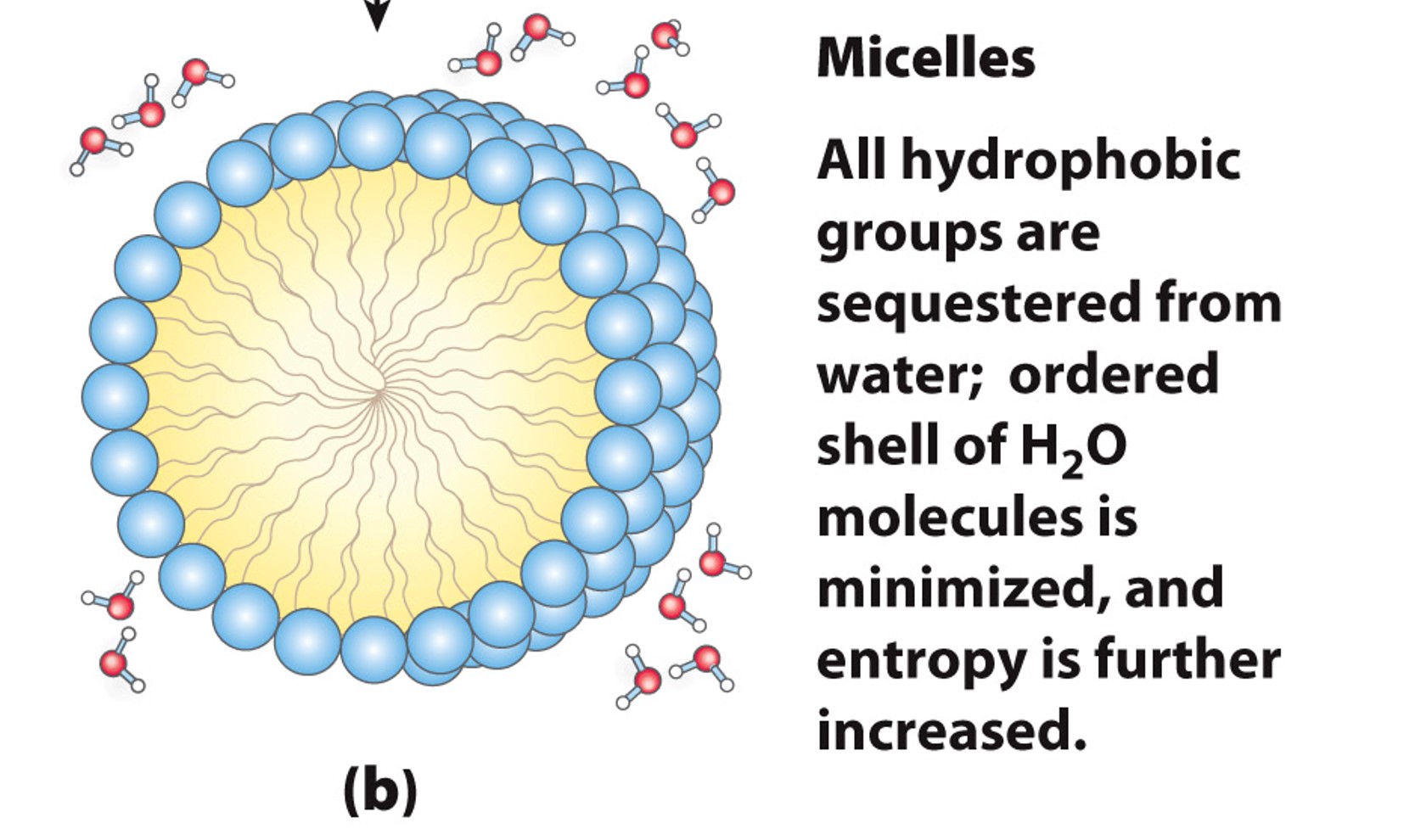
溶质可以改变水的性质
依数性 Colligative
- 沸点、熔点、渗透性……
- 渗透压:水往低处走
- 等渗、高渗(细胞失水)、低渗(细胞吸水)
- 不依赖于溶剂,而和溶质的浓度有关
非依数性 Noncolligative
- 黏度、表面张力、味道、颜色
- 依赖于溶剂的化学特性
水的离子化
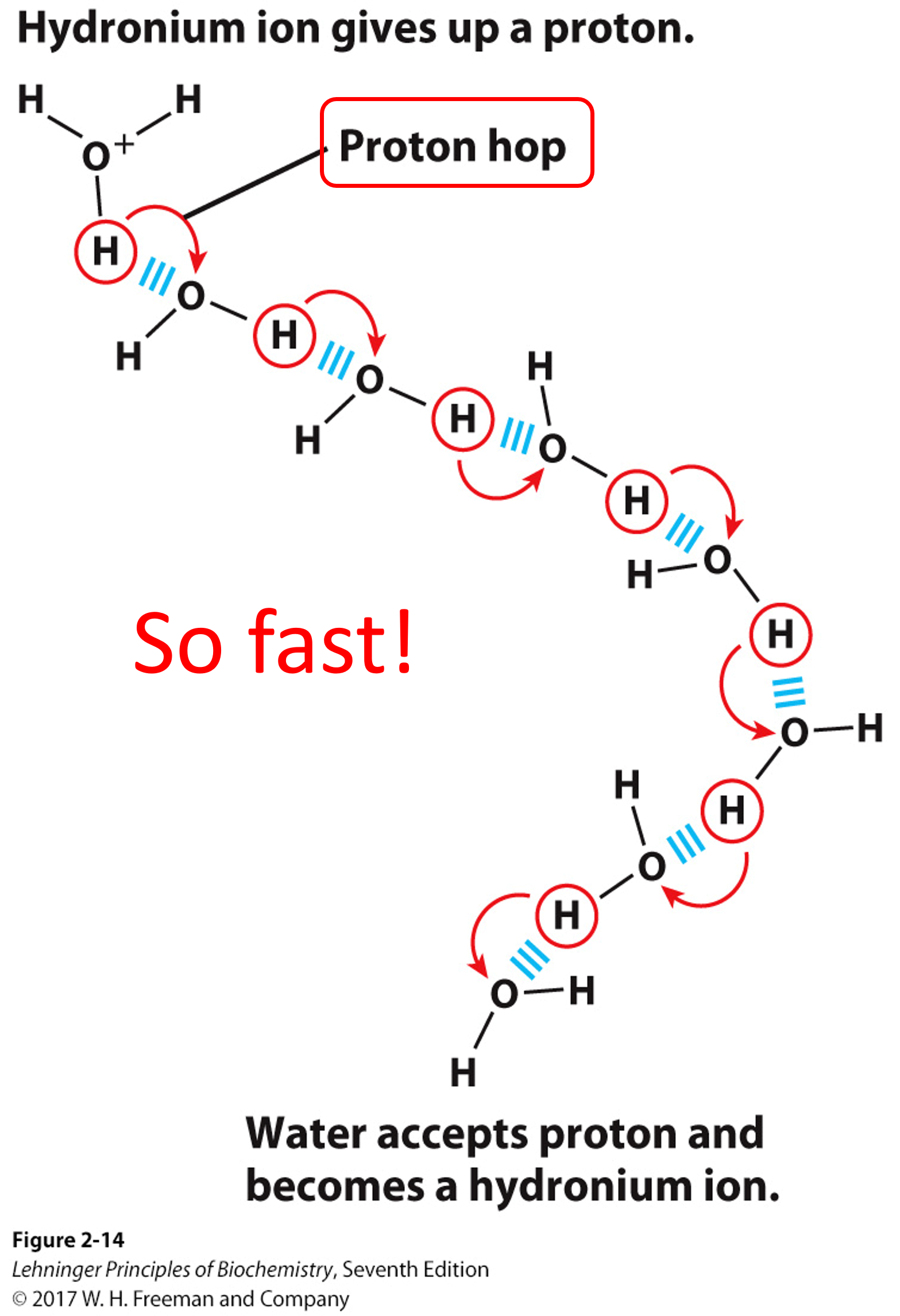
质子水合
- 溶液中不存在自由的质子,会立刻形成水合质子$H_{3}O^{+}$
- 质子跳(proton hopping): 使共价键和氢键互换
Chapter II - Amino Acids And Peptides
Proteins are linear heteropolymers of α-amino acids.
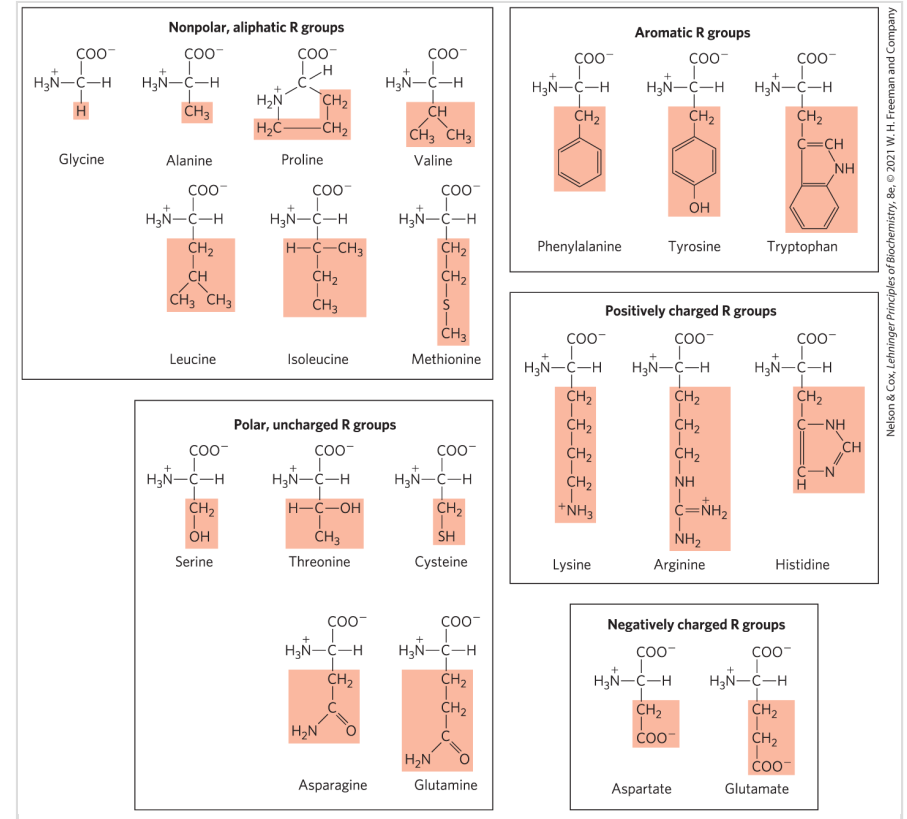
氨基酸的结构
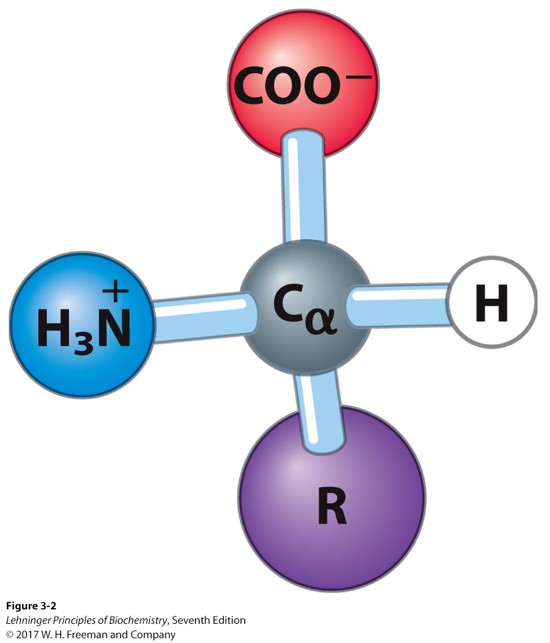
- 羧基、α-H、氨基、R基团
- 除了_甘氨酸_ 以外的所有的氨基酸都是有手性的(Chiral)
氨基酸分类
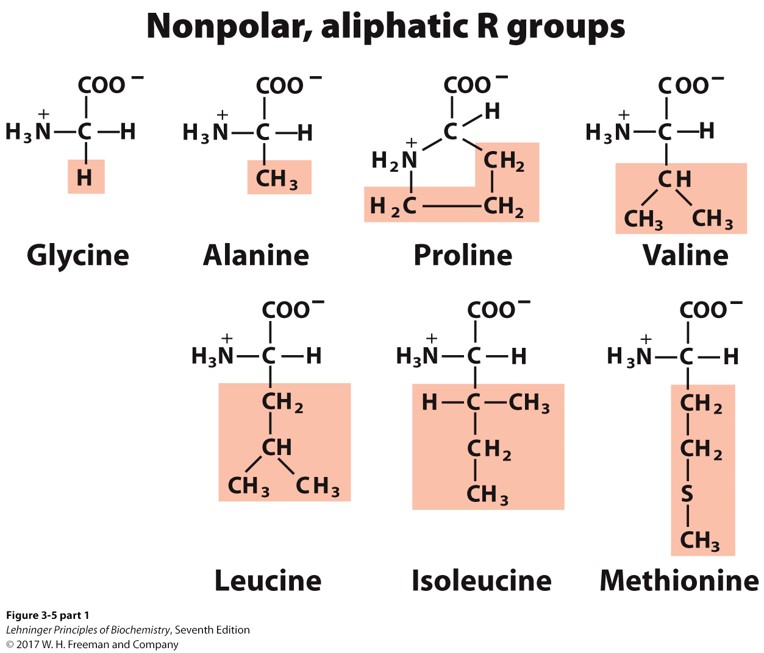
非极性的、带有脂肪链的(7种)
- 甘氨酸 Glycine Gly G 最简单的氨基酸,侧链没有疏水效应
- 丙氨酸 Alanine Ala A 侧链含有一个甲基
- 脯氨酸 Proline Pro P 侧链3个碳,成环,含有脯氨酸的肽段结构自由度(flexibility)会降低
- 缬氨酸 Valine Val V 侧链3个碳,分叉
- 亮氨酸 Leucine Leu L 侧链4个碳,分叉
- 异亮氨酸 Isoleucine Ile I 侧链4个碳,亮氨酸的异构体
- Ala,Val,Leu,Ile因为侧链的疏水效应倾向于聚集在一起,富含这几种氨基酸的肽段有助于稳定蛋白质结构
- 甲硫氨酸 Methionine Met M 侧链含有硫:CCSC
带有芳环的(3种)
- 苯丙氨酸 Phenylalanine Phe F 带有一个Ch_2和一个苯环
- 酪氨酸 Tyrosine Tyr Y 比苯丙氨酸多一个羟基
- 色氨酸 Tryptophan Trp W 两个环
- 极性Phe < Tyr < Trp
极性的,亲水的(5种)
- 丝氨酸 Serine Ser S 常位于催化中心,含羟基
- 苏氨酸 Threonine Thr T 比丝氨酸多一个C,含羟基
- 半胱氨酸 Cyteine Cys C 两个半胱氨酸脱氢可以形成二硫键,稳定蛋白质结构
- 天冬酰胺 Asparagine Asn N 有一个酰胺结构
- 谷氨酰胺 Glutamine Gln Q 比天冬氨酸多一个碳
亲水的,带正电的(3种)
- 赖氨酸 Lysine Lys K 侧链一个氮,在ph7时明显带正电
- 精氨酸 Arginine Arg R 侧链两个氮
- 组氨酸 Histidine His H 在生理状态ph7附近可能是带正电的(质子化状态)或者不带电的,这种特性让组氨酸在很多催化反应中作为质子受体或供体
带净负电荷的(2种)
- 天冬氨酸 Aspartate Asp D 天冬氨酸的酰胺水解,变成$COO^-$
- 谷氨酸 Glutamate Glu E 谷氨酸的酰胺水解,变成$COO^-$
氨基酸的离子化过程
高质子浓度:氨基质子化 带+1电
(ph升高)
中质子浓度:羧基脱氢 带0电,此时氨基带正电,羧基带负电,成为两性离子(zwitterionic)
(ph继续升高)
低质子浓度:氨基脱氢 带-1电
氨基酸的滴定曲线
时氨基酸处于两性离子状态的ph值成为等电点(pI)
利用滴定曲线可以计算等电点:
(该公式适用于没有离子化侧链的氨基酸,侧链带电的氨基酸还要考虑$pK_{R}$)
等电点的性质
- 氨基酸净电荷为0
- 在水中的溶解度最小
- 不会在电场中迁移
应用:作为缓冲溶液
- 在每个$pK_a$附近都可以作为缓冲溶液
- 如甘氨酸有2.34和9.6两个$pK_a$,那么就可以在1.34-3.34或8.6-10.6范围内作缓冲溶液(一般2个单位的范围)
非常见氨基酸及氨基酸的修饰(曾考题)
掺入杂原子或其他基团:硒代半胱氨酸、吡咯赖氨酸……
化学修饰:磷酸化、羟基、甲基修饰……
Peptides
肽键
- 氨基端亲核进攻羧基端的羰碳,脱去一分子水形成肽键(本质就是一种酰胺键)
- 这样的反应在生理ph下若无催化不会自发进行
肽链
- 多个氨基酸脱水缩合,含有若干个肽键的氨基酸多聚体
- 具有多样的功能:
- 激素类:胰岛素、催产素
- 神经肽:疼痛递质
- 抗生素:杆菌肽、多黏菌素B
- 毒素:鹅膏蕈素
Chapter III - Proteins
化学组成
若干条肽链+可能的化学修饰:
- 辅因子cofactor: 金属离子、有机小分子
- 辅酶coenzyme: 有机的辅因子
- 辅基团prosthetic group
- 其他修饰:糖基化……
蛋白质纯化技术
色谱 Chromatography
- 离子交换色谱:柱内有带负电的聚合物珠子,会吸引带正电的蛋白质,组分流出顺序为带大量负电的、少量负电的、少量正电的、大量正电的
- 分子筛色谱:柱内有很多细小通道,小分子蛋白走过的路径长,大分子无法进入,大分子先出,小分子后出
- 吸附色谱:先上柱,再加入特异性配合物,目标蛋白被特异性配合物捕获后洗脱
电泳 Electrophoresis
SDS-PAGE (sodium dodecyl sulfate polyacrylamide gel electrophoresis)十二烷基硫酸钠-聚丙烯酸凝胶电泳
- SDS能打开蛋白质的折叠结构,让蛋白质变成螺旋状,然后烷基链插入每个螺旋之间,暴露出带负电的磺酸基,这样就能让蛋白质带上很多的负电,结合比约为1g蛋白质:1.414gSDS
- 不能用SDS-PAGE分离的蛋白:分子量相近的,不满足这样的结合比的、展开后不是螺旋结构的、表面自带很多电荷的……
- 施加外部电场之后,蛋白质就能在凝胶中向正极迁移
- SDS能使蛋白质原来的形状无关,电泳迁移速率只和分子量有关,小分子迁移的快
- 电泳结束可以进行考马斯亮蓝染色
- G250反应迅速可用于定量
- R250反应较慢(40min),但可以被洗脱,且灵敏度高(下限0.1μg)
- 电泳的Marker:都是单链的、纯粹由氨基酸组成的(即没有糖基化等修饰)
- 可用于计算未知蛋白的分子量:相对迁移距离正比于分子量的负对数
- 含有糖基化、脂质修饰的蛋白不可以用这种方法测量分子量
Isoelectric Focusing 等电聚焦
- 使用两性电解质,施加电场后从负极到正极会形成从高到底的ph梯度
- 在中央点样,蛋白质会移动到等电点的位置,此时蛋白质带电量为0,不再迁移
- 一般需要施加3000V的电压
蛋白质定量技术
吸光度法
- 对于已知含有芳香环氨基酸的蛋白质可以使用朗伯比尔定律测定UV吸光度定量
比活力测定
- activity(活力)反应目标蛋白的功能状况
- specific activity(比活力)是指每毫克蛋白的活力单位数
- 比活力越高,蛋白纯度越高

蛋白质测序技术
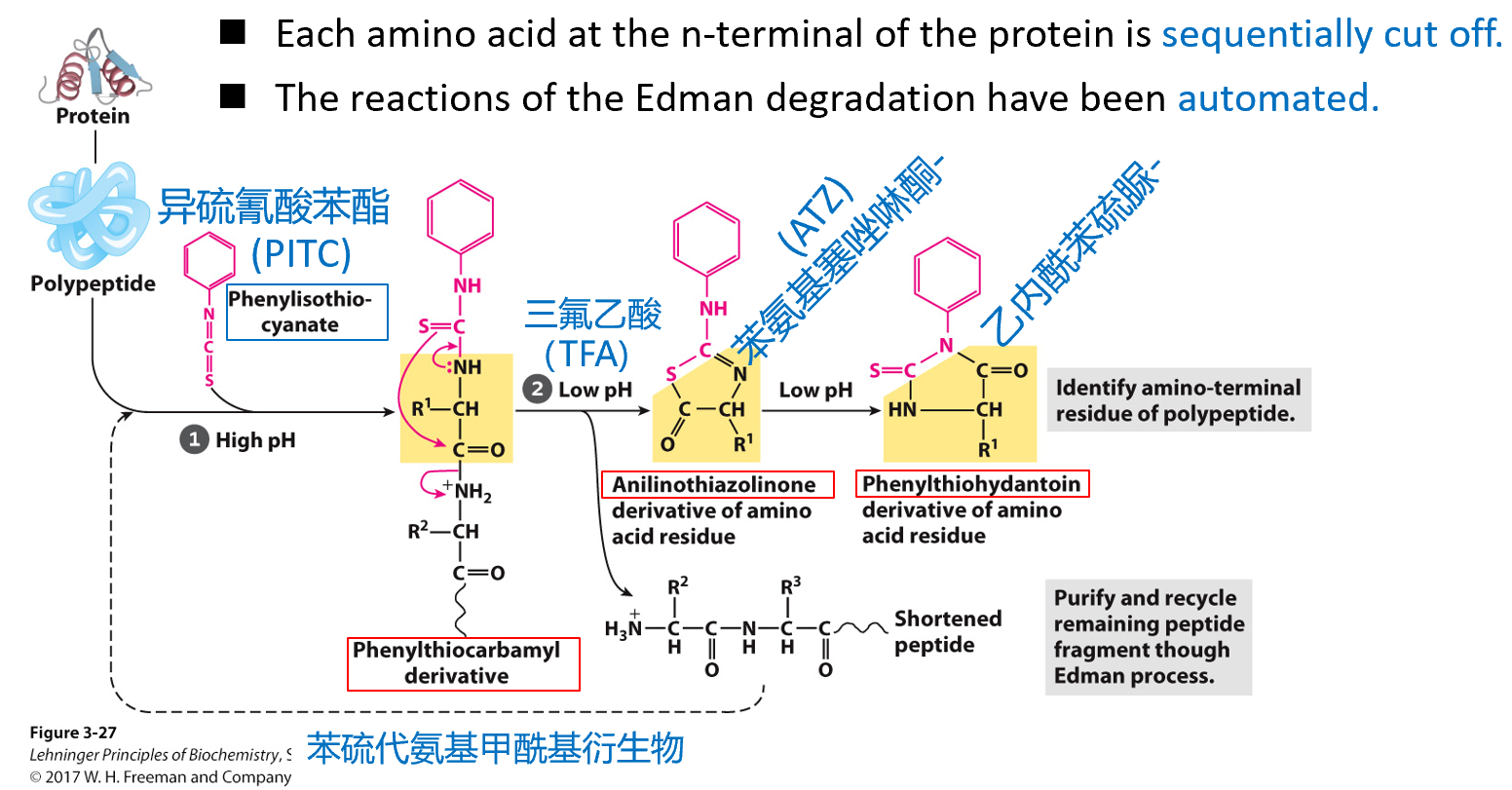
Edman’s Degradation
- 先在碱性环境下PITC与目标肽链氨基末端耦合
- 再酸性环境中切断
- 进一步转化为较为稳定的PTH-氨基酸
- 色谱检测PTH-氨基酸种类
- 开启下一轮反应
酶切法
某些酶可以识别特定的氨基酸序列并在特定位点切断肽链
MALDI质谱法
Chapter IV - The 3D Structure of Proteins
蛋白质的结构
不像大多数有机聚合物,蛋白质分子采用一种特定的三维构象(conformation),这种结构叫做自然折叠(native fold)
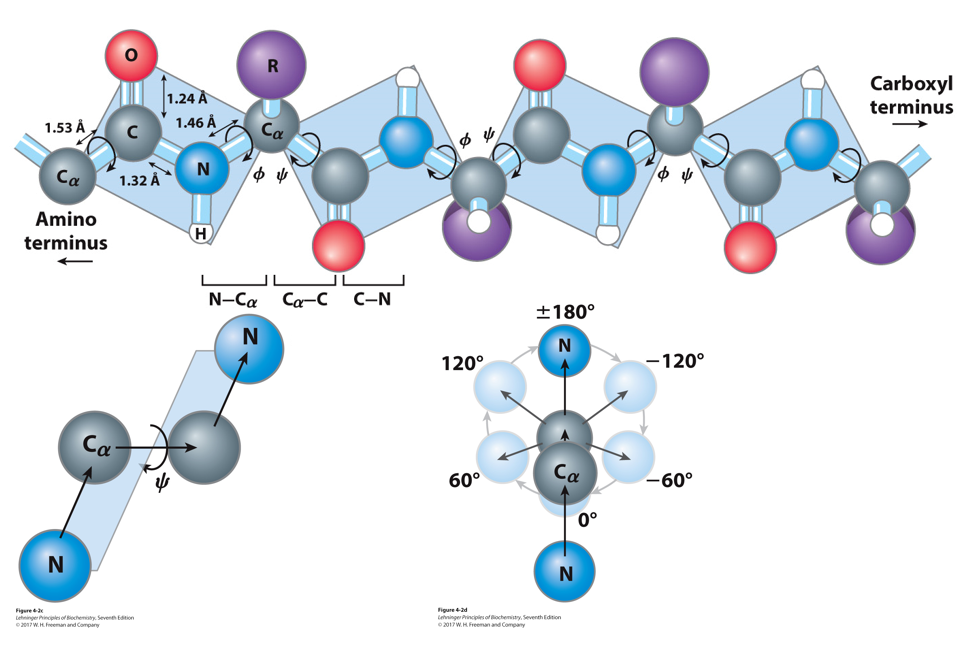
一级结构:肽键
- 由于肽键的共振杂化,肽键是不能旋转的,但是和α-C相连的键是可以转动的
二级结构:多肽骨架的局部空间排列
- 常见的:
- α螺旋 由两个相邻残疾的氢键稳定
- β折叠 由可能不相邻的两条链之间的氢键稳定
- β转角
- 不规则排列:随机螺旋(只是叫这个名字,其实一点都不随机)
- 二级结构的测定方法:圆二色性光谱分析,α螺旋和β折叠有不同的吸收谱线
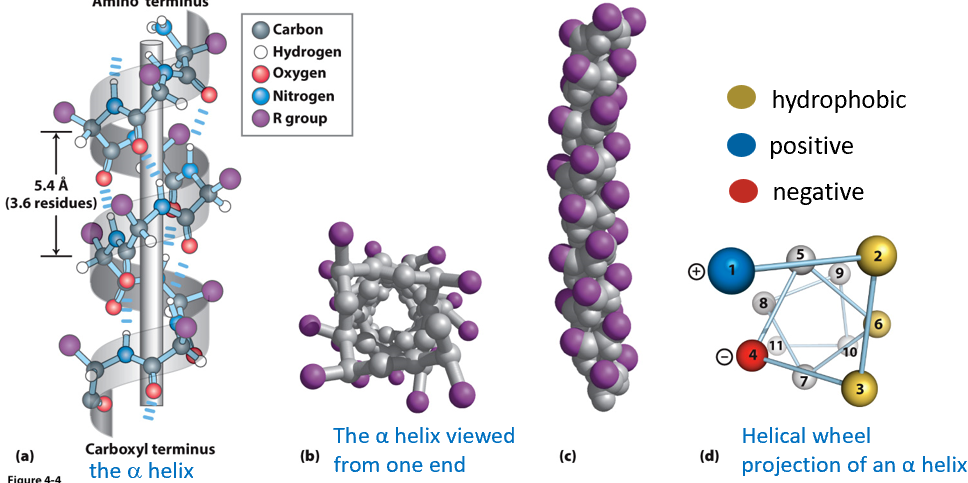
α螺旋
结构特点
- 由第n个氨基酸的O和n+4个氨基酸的N上的H形成氢键来稳定
- 每个螺旋3.6个氨基酸残基(5.4埃)
- 氢键大致平行于螺旋轴排列
- 侧链指向并大致垂直于螺旋轴
- 两亲螺旋:疏水基团全部在一侧,亲水基团 全部在另一侧
- 一般都是右手螺旋
- 俯视图上看,第一个氨基酸和第八个氨基酸是重合的
氨基酸序列对螺旋稳定性的影响
- 具有小的疏水侧链的丙氨酸和亮氨酸是strong helix former
- 脯氨酸是helix breaker,因为它成环了,rotation around the N-Ca (φ-angle) bond is impossible.
- 甘氨酸也是helix breaker,它的R基团支持形成其他的构象
阿尔法螺旋的偶极矩
- N端积累部分正电荷,C端积累部分负电荷
- 这样的偶极矩不利于氨基酸的稳定,因此常在螺旋的N端分布一些带负电的酸性氨基酸或在C端分布一些带正电的碱性氨基酸
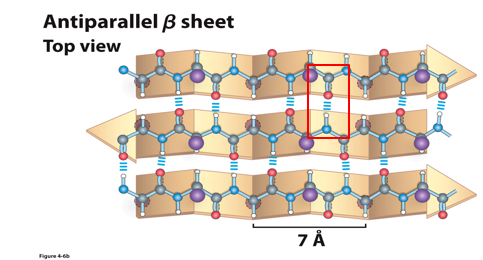
β折叠
结构特点
- β股(β-strand)之间通过主链之间的氢键相互联系,成锯齿状展开
- 至少2条β-strand才能形成β折叠
- R基团在主链上上下交替排列,约与折叠的平面垂直
- 反平行的β股形成的β折叠更稳定(形成氢键的原子共线),平行的β折叠的氢键是扭曲的
- 脯氨酸永远不可能出现在β折叠中
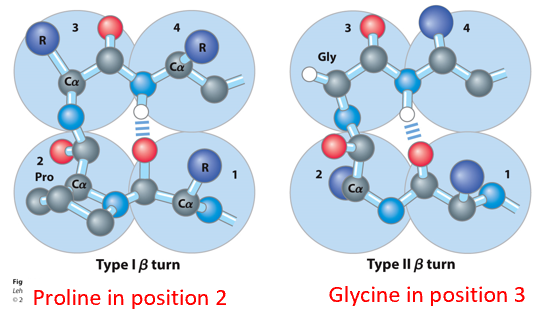
β转角
结构特点
- 由4个氨基酸残基组成,可以导致肽链发生180°转向
- 由第n个氨基酸的O和n+3个氨基酸的N上的H形成氢键来稳定
- 脯氨酸在2号位或者甘氨酸在3号位容易形成β转角
三级结构
纤维状蛋白
- α-角蛋白(α-Keratin): 一种细长的α螺旋
- 两股α螺旋通过左手螺旋的方式形成一种双股螺旋卷曲,即原丝
- 原丝形成原纤维,再形成中间纤维
- β-角蛋白(又称丝绸纤维蛋白Silk Fibroin)
- 反向平行的β折叠结构
- 存在大量的Ala-Gly重复序列,上下两层交错形成氢键
- 胶原蛋白(collagen)
- 含有三条缠绕在一起的多肽链,每一条都是左手螺旋(不是α螺旋)
- 一级结构是重复三元体序列(Gly-X-Y)n ,XY通常是脯氨酸或羟脯氨酸,还有丙氨酸和赖氨酸或羟赖氨酸,引入羟基化氨基酸能够获得新的氢键供体,加强螺旋结构
- 羟基化修饰需要羟化酶,这种酶需要一种辅助因子,就是维生素C,缺维生素C会得坏血病
- 胶原蛋白之间会产生共价交联,弹性和柔韧性减弱,这是组织衰老的表现
水溶性球状蛋白
- 人血清白蛋白:由585个氨基酸残基组成的肽链折叠成球状
模体 Motifs
- 几种二级结构的特定组合

- 是一种重复出现的结构,可以在大量蛋白中被找到
- 单独存在不一定稳定
- 模体是蛋白结构分类的基础
- 在进化的过程中,蛋白质的三级结构比氨基酸序列更加可靠保守,大约只存在1200种模体
- 存在相似三级结构的蛋白质叫做蛋白家族
- 多个蛋白家族具有相似的主要结构模体或相似的功能就叫做超家族
固有无序蛋白
- 包含没有明确定义结构的蛋白质片段
- 由高浓度的Lys, Arg, Glu, and Pro组成,使得结构并不明确
- 固有无序区域(IDRs)可以适应许多不同的蛋白质,从而促进与众多不同伙伴蛋白质的相互作用
例如p53蛋白的IDRs不同的序列可以结合不同的伙伴蛋白,如细胞周期蛋白A,去乙酰化酶等
四级结构
四级结构是由单个多肽链组装成一个更大的功能性簇,从简单的二聚体到大型复合体。
蛋白质稳态
蛋白质在体内的合成、组装、降解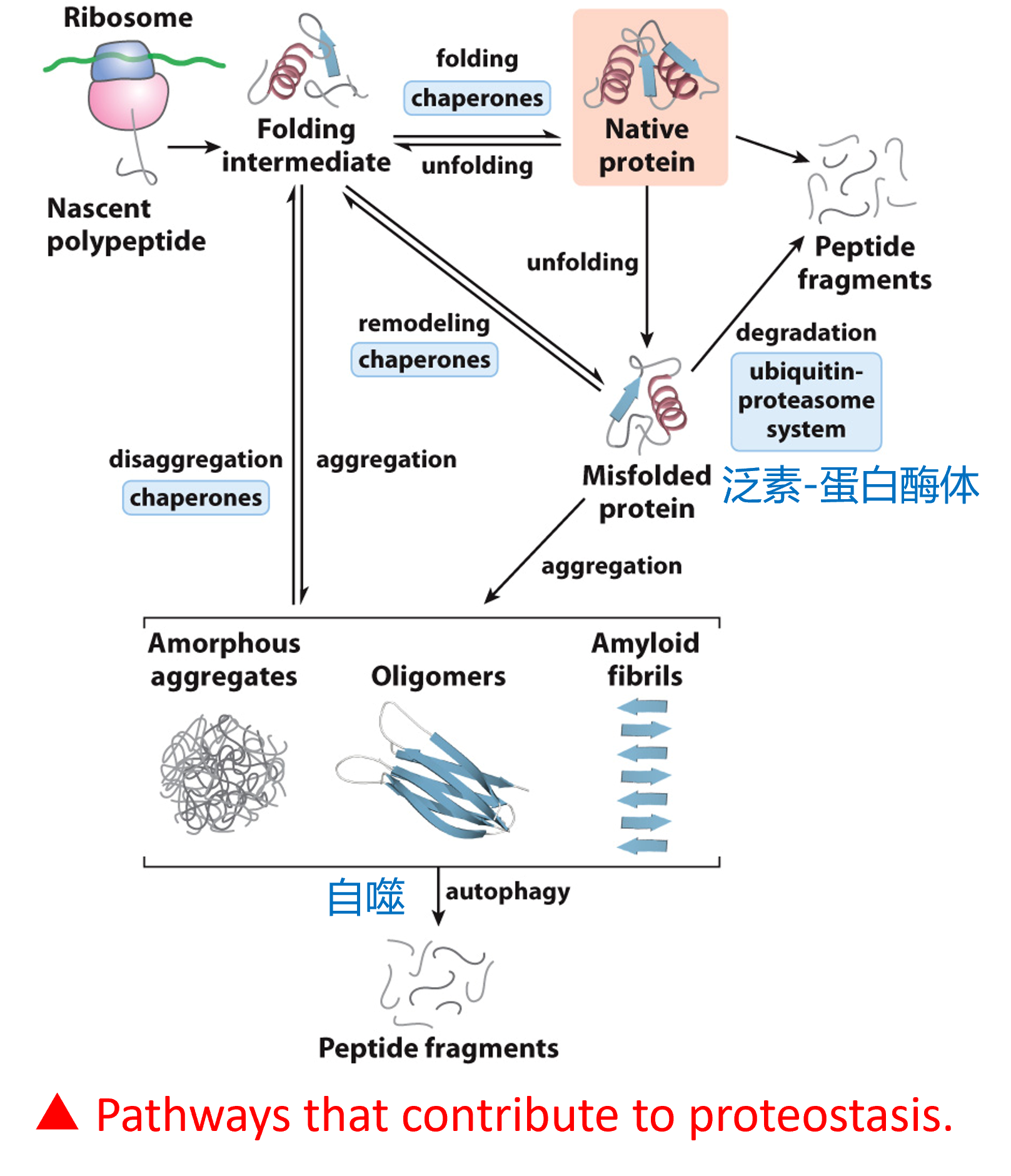
泛素-蛋白酶体
- 泛素-蛋白酶体是一个由大约50种不同蛋白质组成的桶状多酶复合体,本质上是细胞的垃圾箱。细胞不再需要的蛋白质进入该复合体,并在其中央腔内被称为“细胞剪刀”的蛋白水解酶分解。
- 26S泛素蛋白酶体是负责催化大多数(至少80%)生长中的哺乳动物细胞中蛋白质降解的复合体,包括错误折叠和调节性蛋白质的快速降解,以及细胞内大多数蛋白质较慢的分解过程。
新发现的midnolin-proteasome pathway
- 过程不涉及泛素标记,而是通过midnolin的α螺旋结构域与蛋白酶体相互作用,利用其Catch结构域识别并结合底物中的特定区域,这些区域能够形成β链结构,并通过midnolin的泛素样结构域(Ubiquitous-like domain)促进底物的降解
变性 Denaturation 与折叠 Folding
- 过冷过热、极端pH、混合有机溶剂(乙醇和丙酮)、盐酸胍……
- 变形通常会导致蛋白质沉淀
- The Anfinsen Experiment: 核糖核酸酶A有四个二硫键,加入尿素和巯基乙醇使其完全变性,移除变性剂,蛋白质开始重新折叠,二硫键重新形成,实验证明,小的水溶性蛋白质在生理环境条件下的天然结构仅取决于其氨基酸序列,即一级结构决定三级结构
- 蛋白质折叠:蛋白质从伸展的多肽链转变为具有特定三维结构的过程,这是一个层级过程,小的二级结构先折叠,再折叠出大的结构
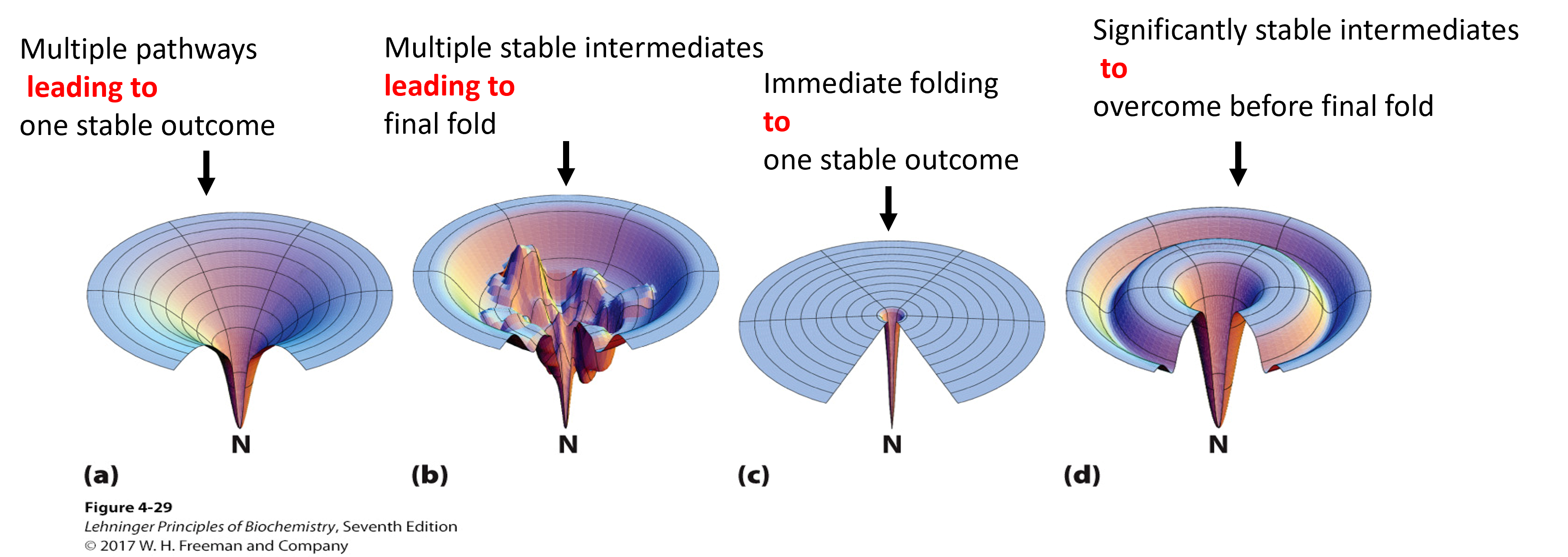
为什么蛋白质折叠得如此之快?
Free-Energy Funnel Model:蛋白质的折叠在热力学上是一个有利的过程,伴随着自由能的降低,漏斗的底部代表蛋白质的原生状态(native state),而漏斗的宽阔部分则代表多种可能的未折叠或部分折叠的中间状态
Foldase + ATP:
- 分子伴侣Chaperones 阻止未折叠肽链的聚集或错误折叠,但并不会极大地促进肽链折叠,常见的有热休克蛋白Hsp60和Hsp70,作用过后的中间产物传递给伴侣蛋白
- 伴侣蛋白Chaperonins GroEL/GroES蛋白复合体能够促进折叠(上下两端都可以工作,极大提高了效率)
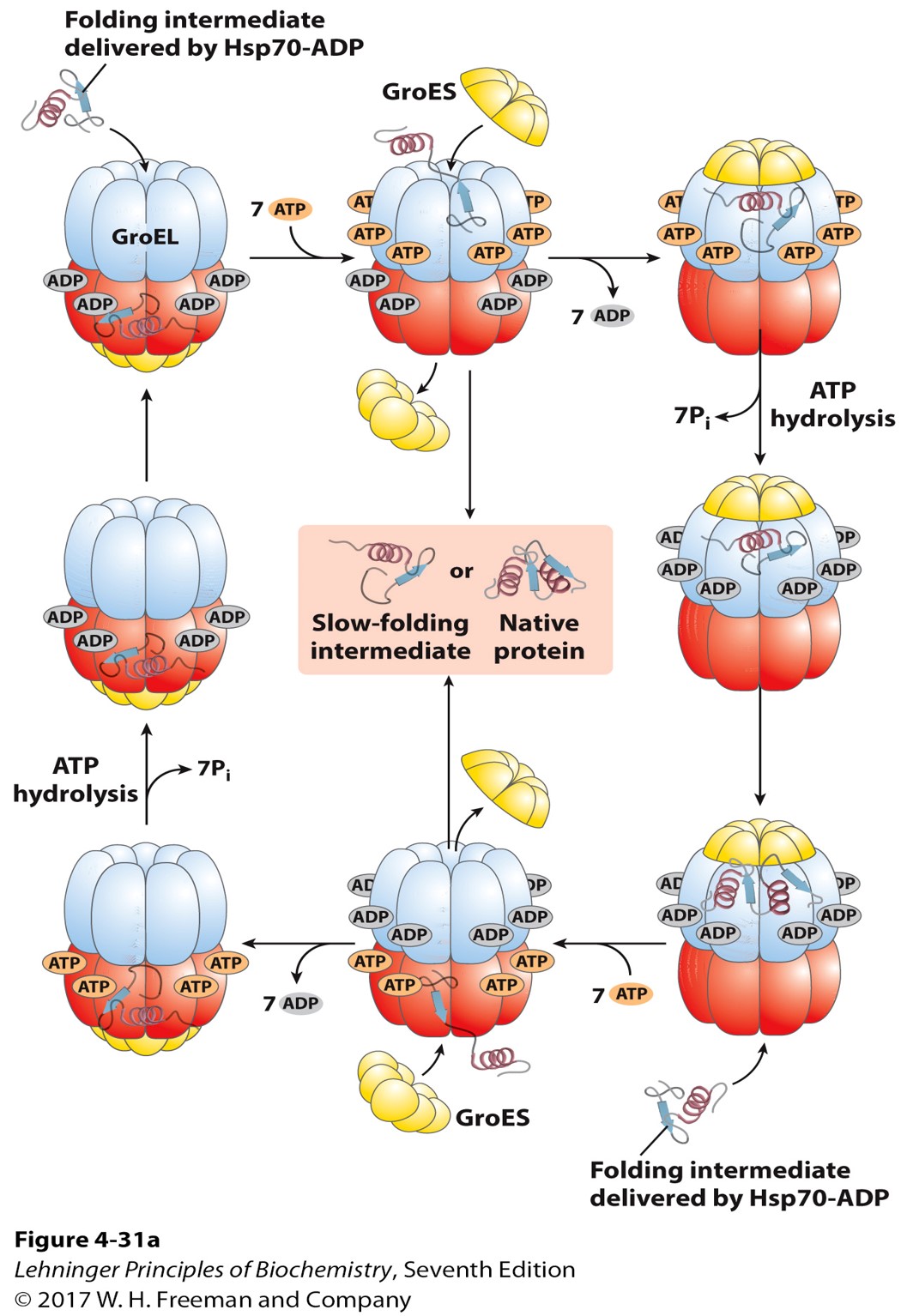
- 错误折叠的蛋白质会引起疾病
- 错误折叠所形成的β淀粉样蛋白(amyloid)的聚集,是人类神经性疾病的主要因素(Aβ和tau蛋白导致的阿尔兹海默症)
- 朊病毒 Prion Protein : 与神经细胞内的一种蛋白质在一级结构上完全相同,只是折叠不同,因为能抵抗消化道水解酶且能被吸收,所以具有传染性,故又称传染性蛋白颗粒。到达脑部后导致脑炎和脑组织出现海绵状空洞
- 正常蛋白$PrP^c$和错误蛋白$PrP^{sc}$相接触,诱导转变
- 朊病毒基因prnp 常染色体突变导致
- 致死性家族失眠症、雅克氏病、疯牛病、遗传性痴呆、新几内亚震颤病
Chapter V Protein Function
- Key term
ligand 配体 binding site 结合位点 affinity 亲和性
蛋白质与配体的短暂可逆结合通常通过非共价作用
蛋白与配体结合的定量描述
- symbol: $K_a = 缔合常数$ $K_d = 解离常数$ P:free protein L:free ligand PL:binding complex
- 平衡方程:
- 结合率:
- 联立上述两式,可得到常用的结果
- 当配体是气体时,可以用[L]可以用分压代替
- 强结合:$K_d < 10nM$, 弱结合$K_d > 10nM$
蛋白结合配体的特异性
锁钥模型 Lock-and-Key
- 该模型认为蛋白质只能结合某种特定的配体
- 蛋白质与配体在大小、形状、电荷、亲水性上互补
诱导契合模型 Induced-fit
- 该模型认为蛋白质和配体都能改变构象,从而互补
- 能够结合地更紧密
- 对不同配体的亲和性不同
Case I:Globins (珠蛋白)
- Problems: 蛋白侧链对氧气的亲和力低,一些过渡金属对氧气结合强但是易产生自由基,血红素对氧的亲和力高但游离态的血红素中的二价铁易被氧化成三价铁而失去作用
- Solutions:用蛋白质包裹血红素来捕获氧气
- 两种珠蛋白:myoglobin肌红蛋白用于储存,hemoglobin血红蛋白用于运输
血红素Heme
一类中心含有二价铁离子的卟啉化合物,除了在血红蛋白中负责结合氧气外,还是肌红蛋白、细胞色素、细胞色素P450、过氧化氢酶、过氧化物酶等多种蛋白的辅因子,并参与调控基因表达、miRNA加工、昼夜节律等过程。
肌红蛋白 myoglobin
- 血红素在中心被两个组氨酸锚定
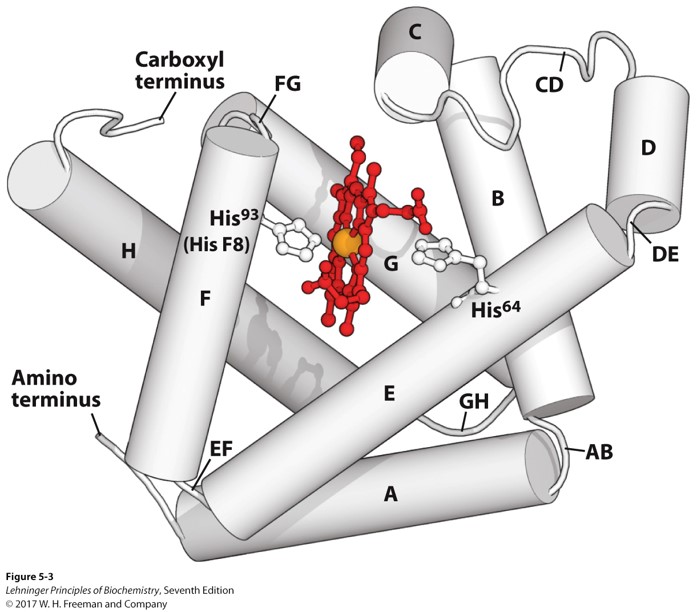
- 一氧化碳与血红素的结合强度比氧气强20000倍,因为CO与铁是直线连接,氧气则有一个夹角 -> 一氧化碳中毒
- 检测:空载的血红素有429nm紫外吸收峰,结合氧气之后吸收峰移动到414nm
血红蛋白 hemoglobin
为什么肌红蛋白不能运输氧气?
- 因为在肌肉中氧气分压约为4kPa,肌红蛋白对氧气的亲和力较高,仍有0.8左右的结合率,若从肺部运输过来,氧气无法释放,必须有一种蛋白在肺部结合率高,在肌肉处结合率低,才能起到运输的作用。
- 能够该变对氧气亲和力的蛋白必须要有多个结合位点,且相互作用,成为协同效应 cooperativity
- 正协同:第一个结合的配体促进之后的配体结合;负协同反之
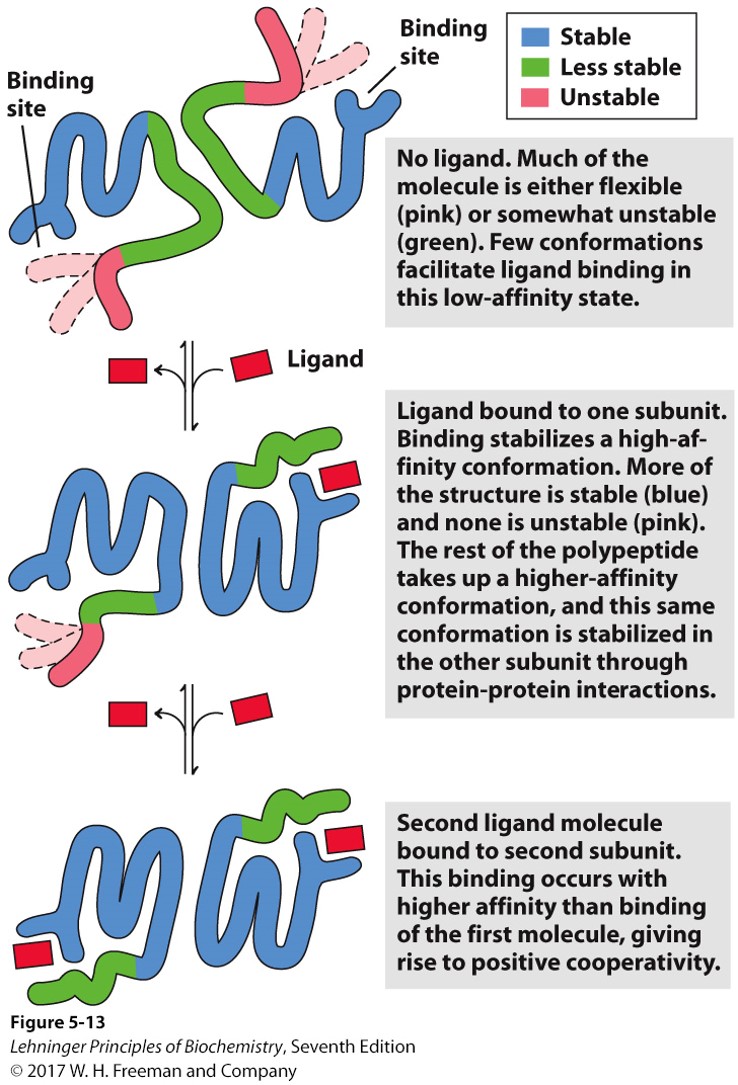
协同效应的定量描述
- 平衡方程修正为:
- 结合率修正为:
- 两边取对数得到希尔方程:
- n=1无协同效应,>1正协同,<1负协同
血红蛋白的结构:
- 两种子单位的四聚体(两个α两个β),每个子单位都和肌红蛋白很像
- 当第一个氧气结合时,α1 β2 链之间的构象会改变,多个离子键断裂
- Tense state:更多的相互作用,更稳定,对氧气的亲和力低
- Relaxed state: 更少的相互作用,更自由,对氧气的亲和力高
- 氧气的结合促使从T -> R的转变
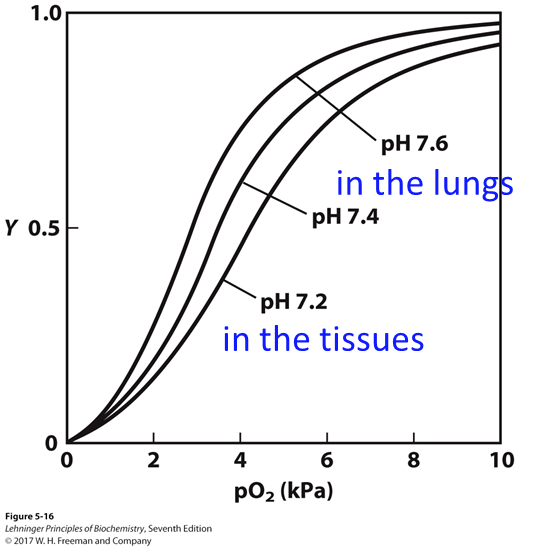
pH值对血红蛋白运输氧气的影响
- 活跃代谢的组织产生$H^+$,使得肌肉组织的pH值比肺部低,
- $H^+$可以稳定T构象,原理是可以质子化$His^{146}$,然后和$Asp^{94}$之间形成盐桥,促进氧气的释放
- 这种pH值的变化增加了氧气运输的效率,即Bohr效应
血红蛋白运输二氧化碳
- 二氧化碳和肽链的氨基末端结合形成氨基甲酸酯末端
- 过程产生质子,进一步加强Bohr效应
- 会形成额外的盐桥,稳定T构象,促进氧气释放
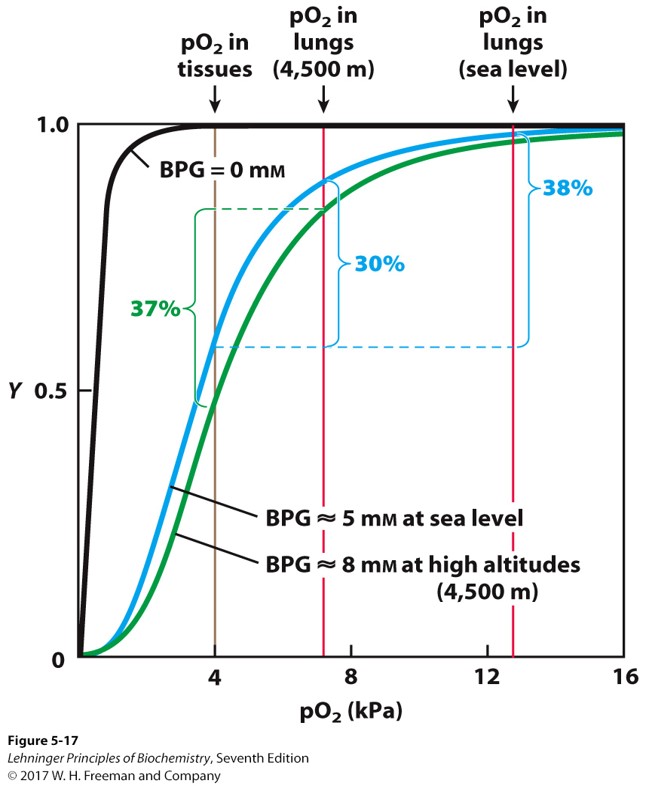
2,3-二磷酸甘油酸 (2,3-BPG)对氧气运输的调节
- 这是糖酵解中产生的小型负电分子
- 可以和血红蛋白中心的正电空腔相结合,稳定T构象,促进氧气释放
- 可以让组织适应不同的海拔高度,高海拔地区提高该物质浓度,增加氧气运输效率
镰状细胞性贫血症 Sickle-Cell Anemia
- 血红蛋白β链第六位谷氨酰胺Glu突变为缬氨酸Val
- 突变后的β链可以结合其他的血红蛋白分子,最终大量分子聚集形成纤维状结晶
- 基因突变导致,纯和个体幼年死亡
Case II : Antibody/Antigen Interaction(抗体抗原结合)
两种免疫系统
细胞免疫
吞噬细胞Phagocytes、巨噬细胞Macrophages识别并吞噬被抗体标记的入侵细胞
体液免疫
- 抗原(自然界大分子、被免疫系统认为是外来者的分子、细菌或病毒的表面蛋白、细胞或病毒的表面糖类分子)刺激B细胞产生抗体,能够和抗原特异性结合
- 抗体用来标记抗原,从而进一步摧毁或干扰其功能
- 一个抗原可以有多个表位(epitope),但一种抗原只能结合一个表位
抗体
免疫球蛋白 G (IgG)
- 两条重链两条轻链,与抗原结合的可变区与下方的不变区
- Fab区与抗原结合,Fc区可被巨噬细胞识别
- 与抗原诱导契合结合,一个IgG可以结合两个抗原
免疫交联技术
- 底物、一抗与底物结合、被改造过的二抗(能和化学荧光物质结合或能催化颜色反应)与一抗结合、荧光物质能与二抗结合并被检测到或产生颜色反应
- 应用实例:ELISA(酶联免疫吸附测定)技术检测人单纯疱症病毒HSV,一抗是抗HSV抗体,二抗是连接有辣过氧化物酶的人IgG,HSV载量最后反应为黄色的深浅
Case III:Muscle Proteins (肌蛋白)
肌肉的结构
- 肌球蛋白Myosin 和 肌动蛋白Actin -> 肌原纤维 -> 肌纤维
- 肌球蛋白组成粗的丝状物,头部氨基端纺锤状,尾部是两股α螺旋
- 肌动蛋白组成细的丝状物,G-actin组装成两股右手螺旋
- 肌球蛋白的头部沿着肌动蛋白滑行
肌肉的运动需要化学能
- 肌动球蛋白循环:每消耗一个ATP,肌球的头往前移动3格
肌肉收缩的调节
- 肌球蛋白在肌动蛋白上的结合位点收到肌钙蛋白Troponin和原肌球蛋白Tropomyosin的调节
- 神经冲动导致钙离子的释放,使得tropomyosin-troponin complex的构象改变,暴露肌动蛋白结合位点
- 这样能避免肌肉持续性的收缩
Chapter VI Enzymes
什么是酶?
- 一种生物催化剂
- 大多数是球蛋白,但也有少数是RNA ,称为核酶
- 全酶Holoenzyme = 脱辅基酶 + 辅酶/辅因子(一些维他命,金属离子等)
- 酶的分类:氧化还原酶、转移酶、水解酶、裂解酶、异构酶、连接酶
酶促反应
- 酶和底物通过非共价作用结合
- 酶促反应的特点:高特异性、反应温和、速率高、可被抑制剂调控
- 催化通常再酶的活性位点发生active site
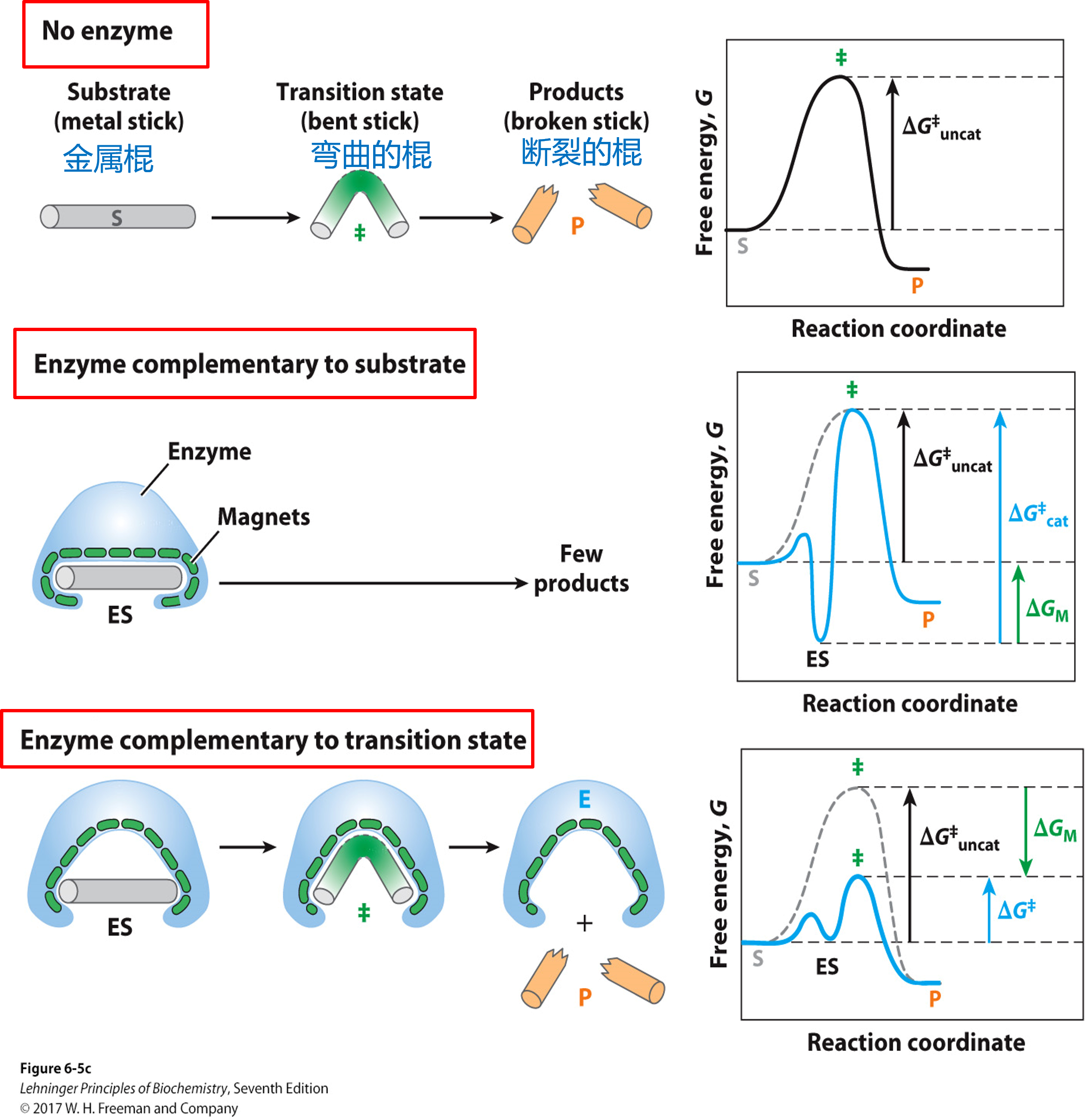
酶改变的是反应的速率,而不是平衡常数,意味着酶无法改变反应的自由能,但是能降低反应的能量壁垒(活化能)$\Delta G^{++}$
如何降低活化能?
- 熵效应:Enzymes organize reactive groups into close proximity【邻近】 and proper orientation【定向】.The entropy cost is paid during binding. 结合能抵消熵减
- 焓效应:酶和过渡态结合得最好,一般在结构上与其互补,利用张力效应使得底物形变(若与原始底物结合得最好,ES过于稳定,能量壁垒会更高)
催化机理
- 一般包含 酸碱催化、共价催化、金属催化 中的一种或多种
- 广义的酸碱催化:即质子转移,如蛋白酶水解肽键
- 共价催化:酶和底物形成短暂的共价键,从而改变反应路径,需要酶上有一些亲核基团
金属催化:稳定带负电的物质,常参与氧化反应
Example 1: 凝乳蛋白酶使用酸碱和共价催化,切断芳香氨基酸后面的肽键
- Example 2:溶菌酶使用酸碱和共价催化切断细菌细胞壁肽聚糖的β1->4糖苷键,水解细胞壁,使细菌死于渗透压
酶动力学
底物浓度对反应速率(一般指初始速率)的影响
米氏方程的推导(研究条件:[S]≫[E],测定速度指初始速度$v_0$,单分子反应)
- 定义ES生成速率常数为$k_1$,ES解离为E+S速率常数为$k_2$,ES生成E+P速率常数为$k_3$
- $[E_{Tot}]=[E]+[ES]$ so the Rate of ES formation = $K_1([E_{Tot}] – [ES])[S]$
- $[S_{Tot}]=[S]+[ES] \approx [S]$ so the Rate of ES breakdown = $K_2[ES]+K_3[ES]$
- 当系统处于稳态时 $K_1([E_{Tot}] – [ES])[S]=K_2[ES]+K_3[ES]$
- 解[ES]得:
- 令$K_m=\frac{k_2+k_3}{k_1}$,可得$[ES]=\frac{[E_{Tot}][S]}{K_m+[S]}$
- 在初速率范围内,逆反应速率可以不考虑,即$v=K_3[ES]$,带入上式得$v=\frac{K_3[E_{Tot}][S]}{K_m+[S]}$
- 当所有酶都形成ES时,反应速率最大,即$V_{max}=K_3[E_{Tot}]$
- 再次代换即可得到米氏方程 $v = \frac{V_{max}[S]}{K_m+[S]}$
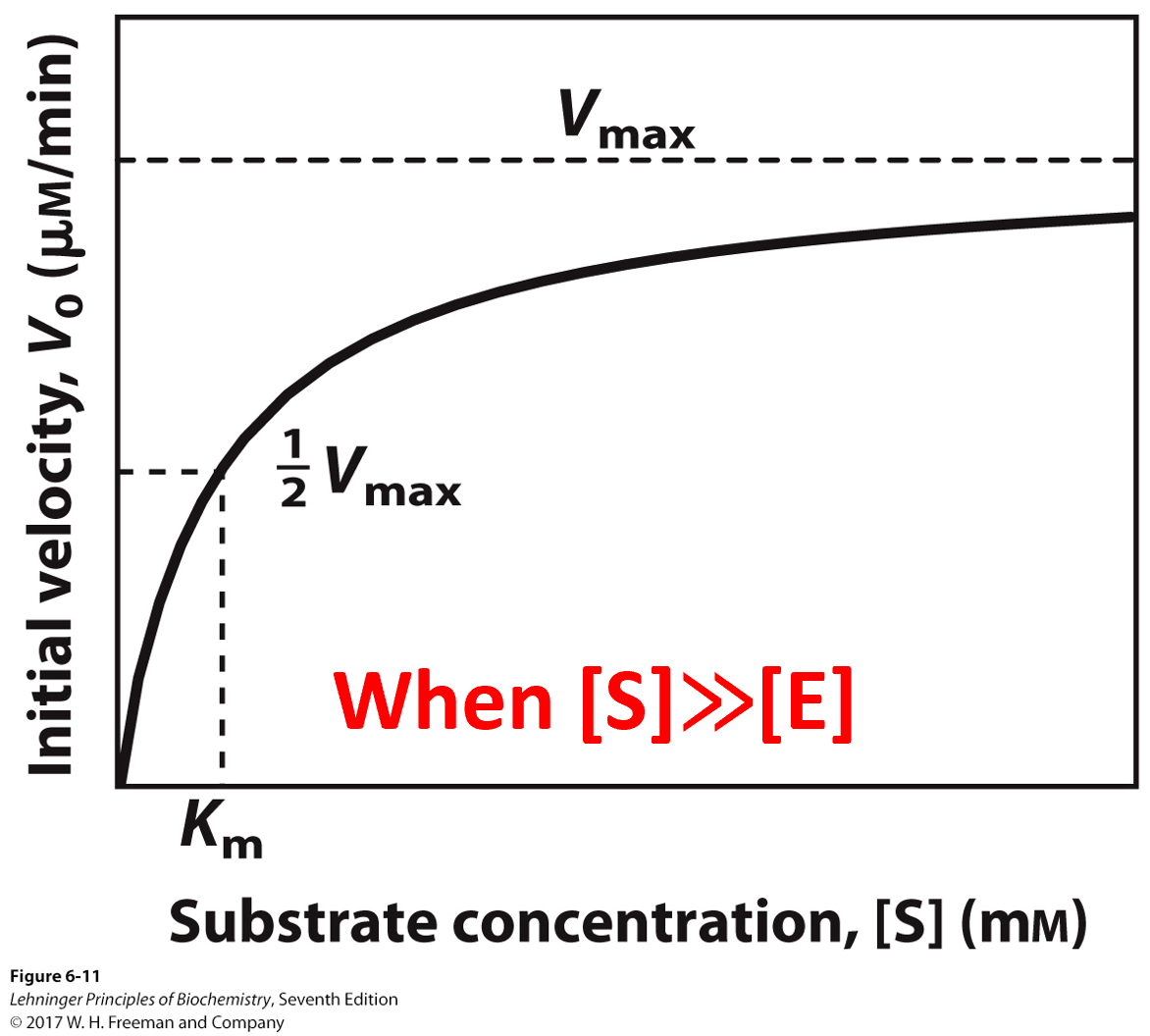
$K_m$与$V_{max}$
- $K_m$值等于反应速率为最大速率一半时候的底物浓度
- $K_m$是酶的特征常数,与酶的结构、底物结构、pH、温度和离子强度有关,与酶浓度无关
- 当$K_3$为反应的限速步骤时,此时$K_m \approx \frac{k_2}{k_1}$,即为ES解离为E+S的解离常数,可以表示酶对底物的亲和力。$K_m$越大,亲和力越小,反之亲和力越大
- $V_{max}=K_3[E_{Tot}]$,$K_3$又被称为酶的转换数,单位为$s^{-1}$
曲线图像解读
- 随着[S]的增大,$v_0$先近似线性增加,后增加逐渐缓慢,最后几乎恒定
- $v_0$ 趋近但永远无法达到 $v_{max}$
双倒数法求解$K_m$与$V_{max}$
- 米氏方程两边同时取倒数:
- 用 1/v 对1/[S]作图,纵截距为$1/[V_{max}]$,横截距为 $-1/K_m$
多分子反应
- 序列机制与乒乓机制
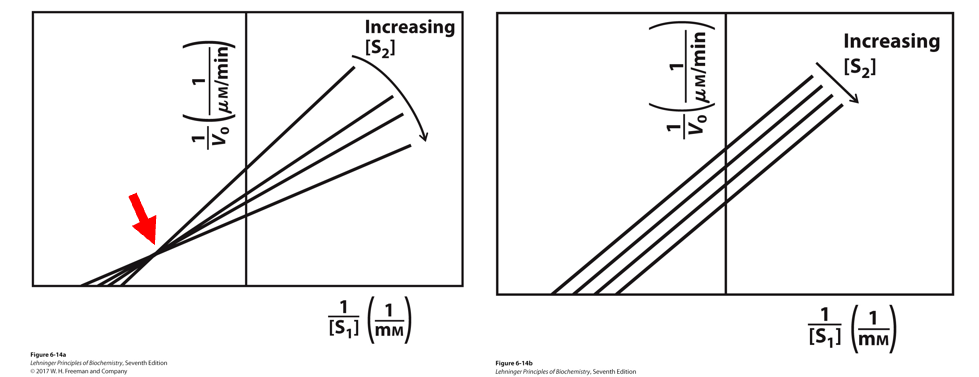
序列机制(底物和酶一个一个结合上去,最后一起分离)
- 控制一个底物的浓度不变,改变另一个底物的浓度,双倒数法作图
- 多根图线会交叉,表明反应中出现了三元复合物,是序列机制
乒乓机制(底物1结合释放,再底物2结合释放)
- 控制一个底物的浓度不变,改变另一个底物的浓度,双倒数法作图
- 多根图线会平行,表明反应是乒乓机制
酶抑制剂 inhibitor
不可逆抑制剂
- 与酶的活性中心共价结合,使其永久失活
可逆抑制剂
竞争性抑制剂
- 与底物结构相似,可与活性中心结合,阻止底物的结合
- 不影响$V_{max}$,但会使$K_m$增大,即酶和底物的亲和力下降
- 通过提高底物浓度可以抵消这种抑制作用
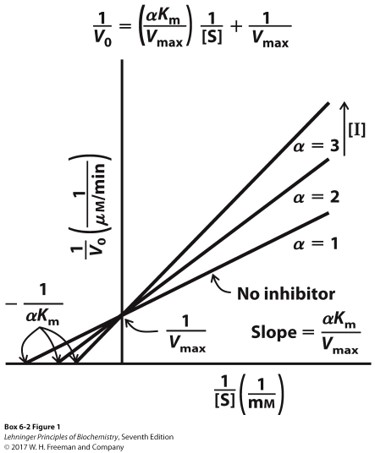
反竞争性抑制剂
- ES的结合,产生了抑制剂的结合位点,产生ESI复合物
- ESI的形成减少ES转变为产物,$V_{max}$下降,但同时降低了ES的浓度使得$K_m$降低
- 总体表现为最大速率降低,酶与底物的亲和力增加
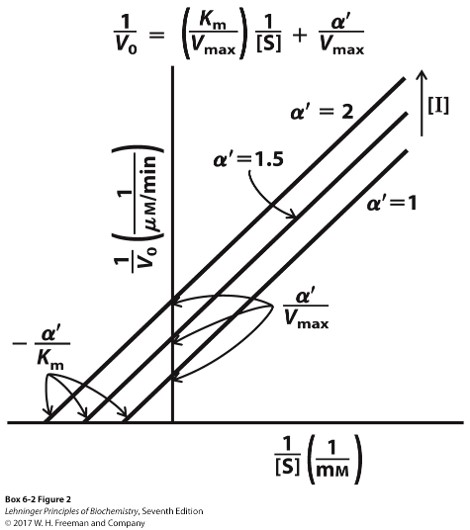
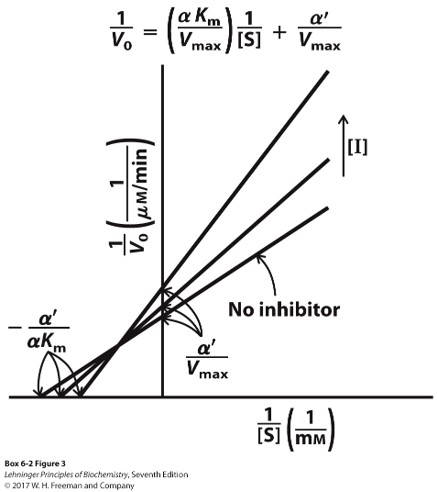
混合型抑制剂
- 与活性中心以外的调节位点结合
- $V_{max}$下降,$K_m$改变
- 特殊的,$K_m$不变的混合型抑制剂称为非竞争性抑制剂
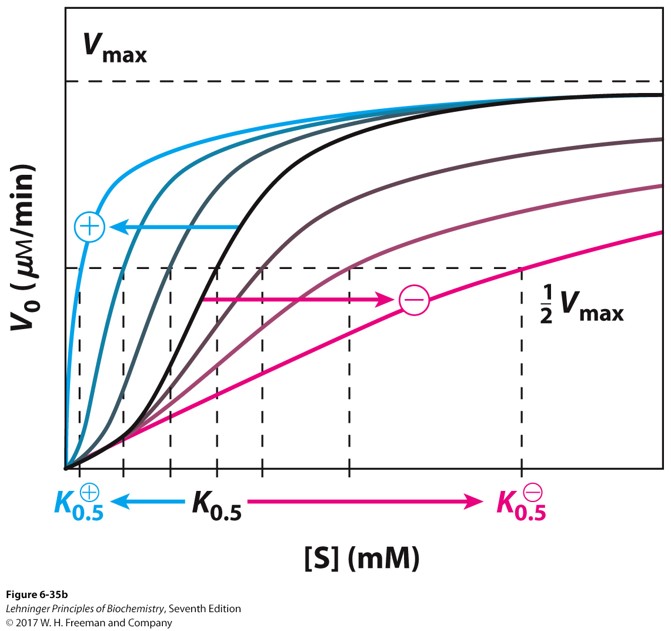
酶的调节
非共价修饰:别构效应 allosteric
- 别构剂与酶的别构位点结合,引起酶构象的改变,类似于血红蛋白
- 可能促进也可能抑制(下图曲线,左移促进,右移抑制)
可逆共价修饰
- 磷酸化、腺苷酰化、乙酰化、豆蔻酰化、泛素化、ADP核糖基化、甲基化
酶原
- 酶原使具有催化活性的酶的前体物质,需要通过化学修饰或剪切,使活性中心形成或暴露,从而具有催化活性
Chapter VII Carbohydrates and Glycobiology
什么是碳水化合物?
- 化学式$C_n(H_2O)_n$,俗称糖类
- 在植物中通过光合作用产生
- 大多数是酮类或醛类化合物,或者可以通过水解产生酮或醛
- 分类:单糖、寡糖、多糖、糖缀合物
- 多样的功能:功能储能、形成外骨骼、结缔组织、细胞信号传递
- 生化中常见的碳水化合物:核糖ribose标准的五碳糖,葡萄糖glucose标准的六碳糖
立体异构 Stereoisomerism (以下均考虑多个手性中心的情况)
同分异构体 Constitutional Isomers
- 甘油醛(醛糖aldose)与二羟基丙酮(酮糖ketose)是同分异构体
- 这是两个不同的糖类家族
对映异构体 Enantiomers
- 有手性中心chiral center的物质就存在对映异构体,两者互为镜像
- D 是右手螺旋 L是左手螺旋(在糖中构象由离羰基最远的手性中心决定)
- 对映异构体具有相同物理性质,但生物中的六碳糖大多数是D构型
- 少数简单的糖类,如阿拉伯糖是L构型
非对映异构体 Diastereomers
- 立体异构但两者不是镜像
- 具有不同的物理性质
差向异构体 Epimers
- 仅有一个手性中心构象不同
- 一定不是对映异构的
- 大于三个手性中心的物质,作两次差向异构,可以形成非对映异构体
单糖成环反应
- 在水溶液环境中,链状酮糖醛糖倾向于形成环状结构
- 这是一个半缩醛反应,羰基碳被还原成了醇
- 反应可逆,但化学平衡向成环的方向
- 原先的羰基碳在环中被成为异头碳,会有α/β构象,羟基朝下为α,羟基朝上为β,水溶液中可以互相转换
- 六元环糖又叫吡喃糖,五元环糖又叫呋喃糖
实际的构象不是平面圆环,是椅式构象
还原糖检测反应:
- 有异头碳的单糖或二糖,由于化学平衡,必然存在部分未还原的羰基或醛基,可以还原氧化性物质
- 菲林试剂:二价铜被还原到一价
- 土伦试剂:银离子被还原到金属银
- 比色法:葡萄糖氧化酶在氧化葡萄糖的过程中,会产生双氧水,在体外能够将还原型邻联茴香胺氧化成氧化型邻联茴香胺(生物中由过氧化物酶代谢有害的双氧水),茴香胺的反应是一个颜色反应,可以用比色计测得
糖苷键 Glycosidic Bond
糖苷键的形成
- 双分子间形成糖苷键比单分子的缩醛hemiacetal更稳定
- 一个葡萄糖的异头碳与另一个葡萄糖的4号位羟基反应,脱去一分子水,形成二糖Disaccharides,两分子葡萄糖形成的俗称麦芽糖,糖苷键用“α1->4”表示
- 一分子葡萄糖和一分子半乳糖,β1->4糖苷键形成乳糖
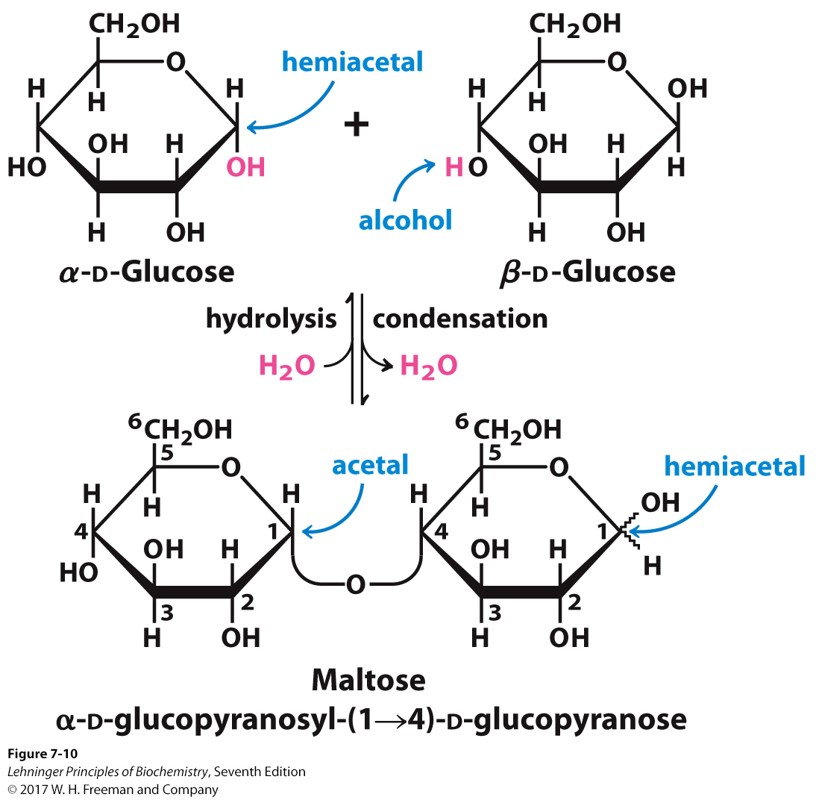
非还原性二糖
- 麦芽糖和乳糖都是还原糖,任然存在一个半缩醛
- 蔗糖$2\beta \leftrightarrow \alpha1$糖苷键,形成了完整的缩醛,不再具有还原性
- 海藻糖$1\alpha \leftrightarrow \alpha1$糖苷键,也是非还原性二糖
多糖 Polysaccharides
- 同多糖:一种单体聚合 杂多糖:多种单体聚合
- 线性:一种糖苷键 分支:多种糖苷键
- 多糖的分子量难以确定,处在不断变化的状态,且合成不需要模板
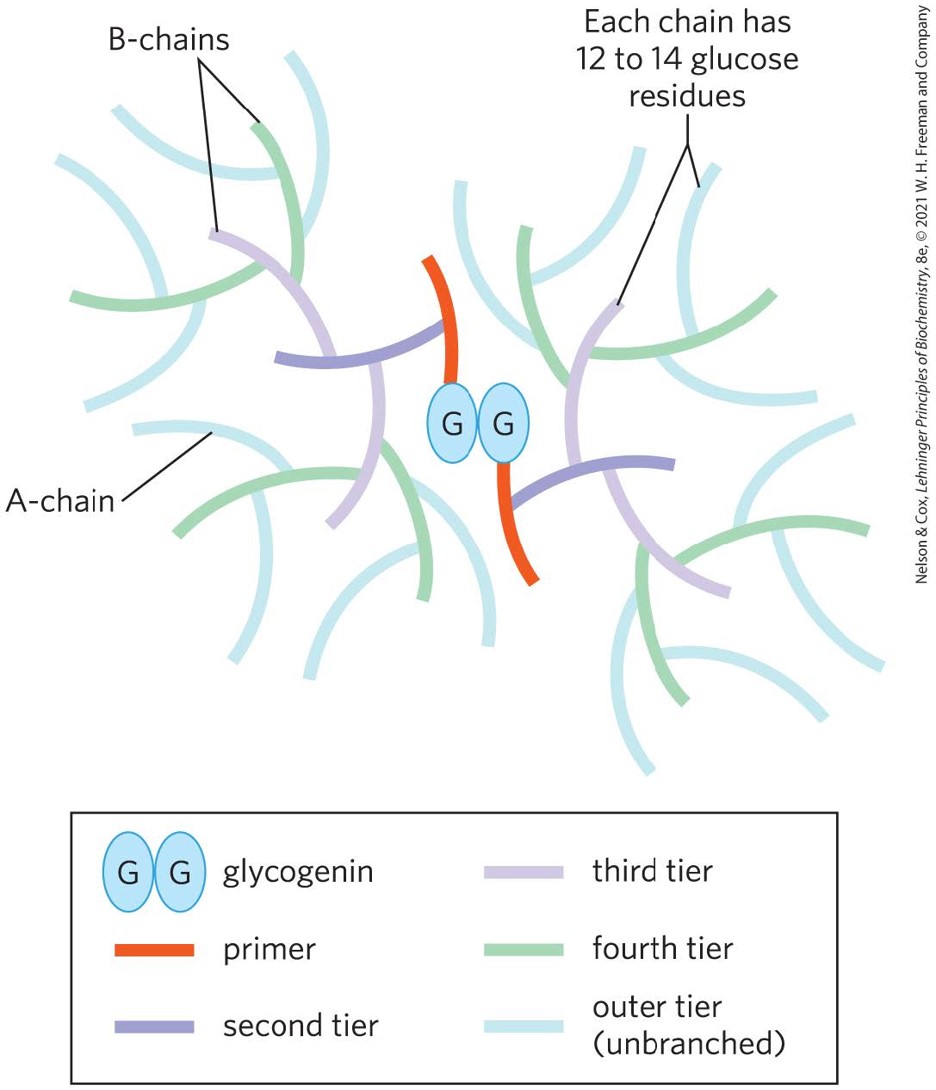
糖原Glycogen:一种分支结构同多糖
- 多分支葡萄糖单体聚合物,常储存于肝脏和肌肉中,脊椎动物的能量储存物质
结构
- 单体连接采用α1->4糖苷键,分支处采用α1->6
- 每条链12-14各葡萄糖残基
- 起始于糖原蛋白同源二聚体
- 外侧A链无分支,内侧B链每8-12各葡萄糖残基就会有一个分支
糖原的分解
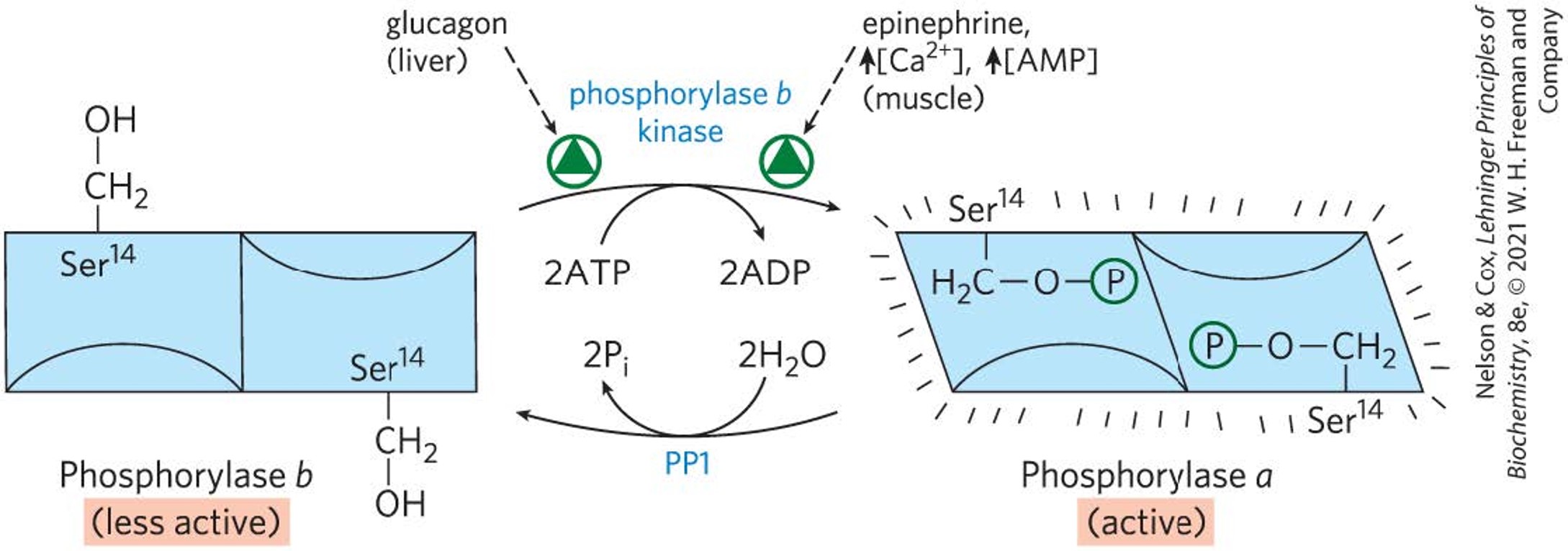
- 糖原磷酸化酶glycogen phosphorylase分解糖原产生磷酸化的葡萄糖
- 反应与水解不同,需要一个磷酸基团,连在糖苷键的氧上
- 肌肉中磷酸葡萄糖进入糖酵解,肝脏中去磷酸化后进入血液
糖原的合成
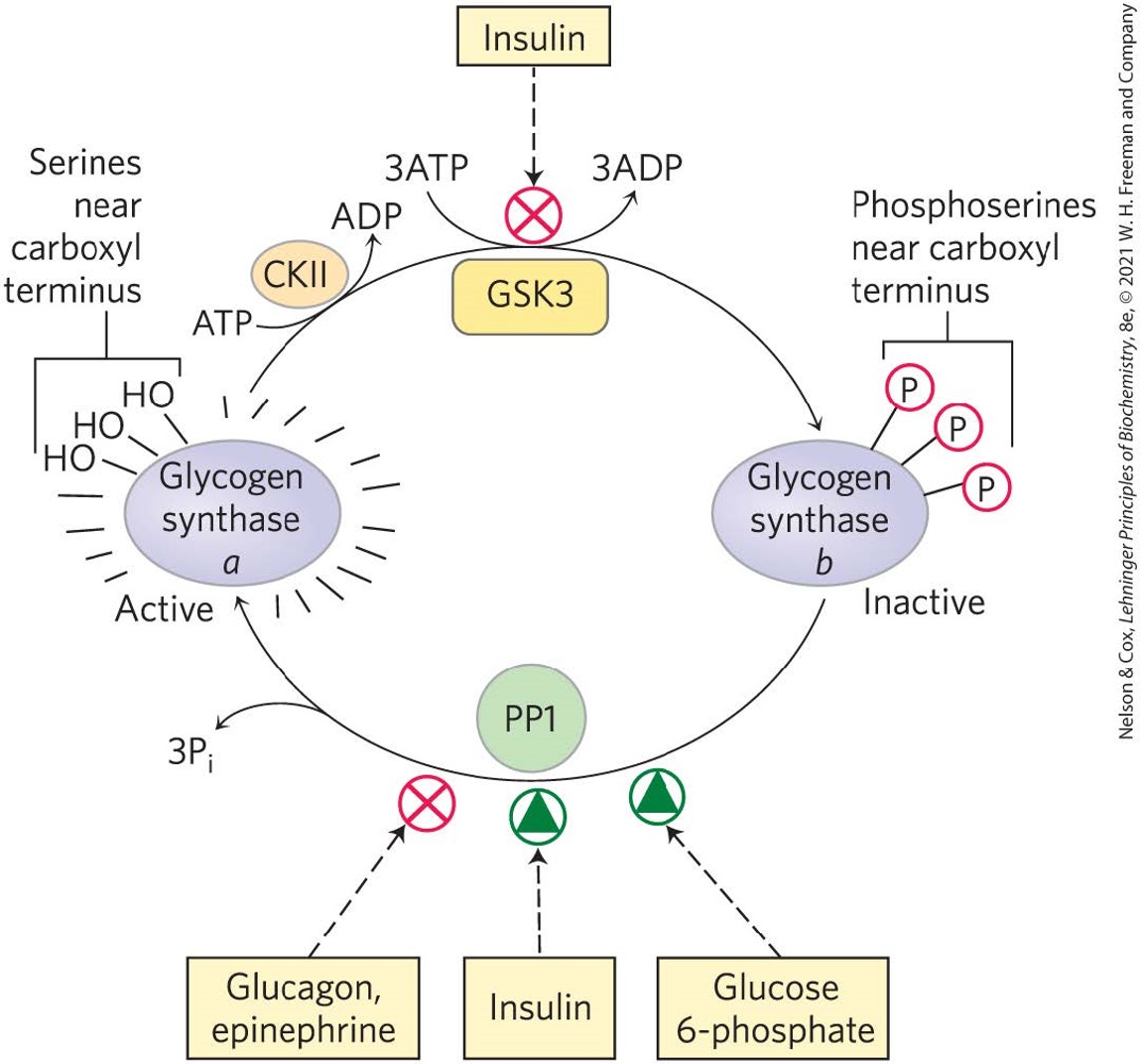
- 由糖原合成酶glycogen synthase催化
- 反应需要已经连接由n个葡萄糖残基形成的链的糖原蛋白参与,尿嘧啶二磷酸葡萄糖(UDP-glucose)作为底物,将葡萄糖转移到糖原链上
- 糖原合成酶不能凭空催化多糖链的形成
糖原合成与分解的调控
- 肝脏中胰高血糖素,肌肉中肾上腺素,能用两个ATP把糖原磷酸化酶激活,促进糖原分解
- 糖原合成激酶3(GSK3)促进糖原合成酶的去活性,减少糖原合成。但该过程能被胰岛素insulin抑制,使得糖原合成酶保持活性,持续合成糖原来降低血糖
淀粉Starch:两种同多糖的混合物
- 直链淀粉与支链淀粉混合而成,均为葡糖糖聚合物,是植物的主要储能物质
结构
- 直链淀粉α1->4糖苷键,支链淀粉每24-30个残基有一个α1->6糖苷键产生分支
- 直链淀粉会形成螺旋
- 分子量过高,在细胞中形成不可溶淀粉粒
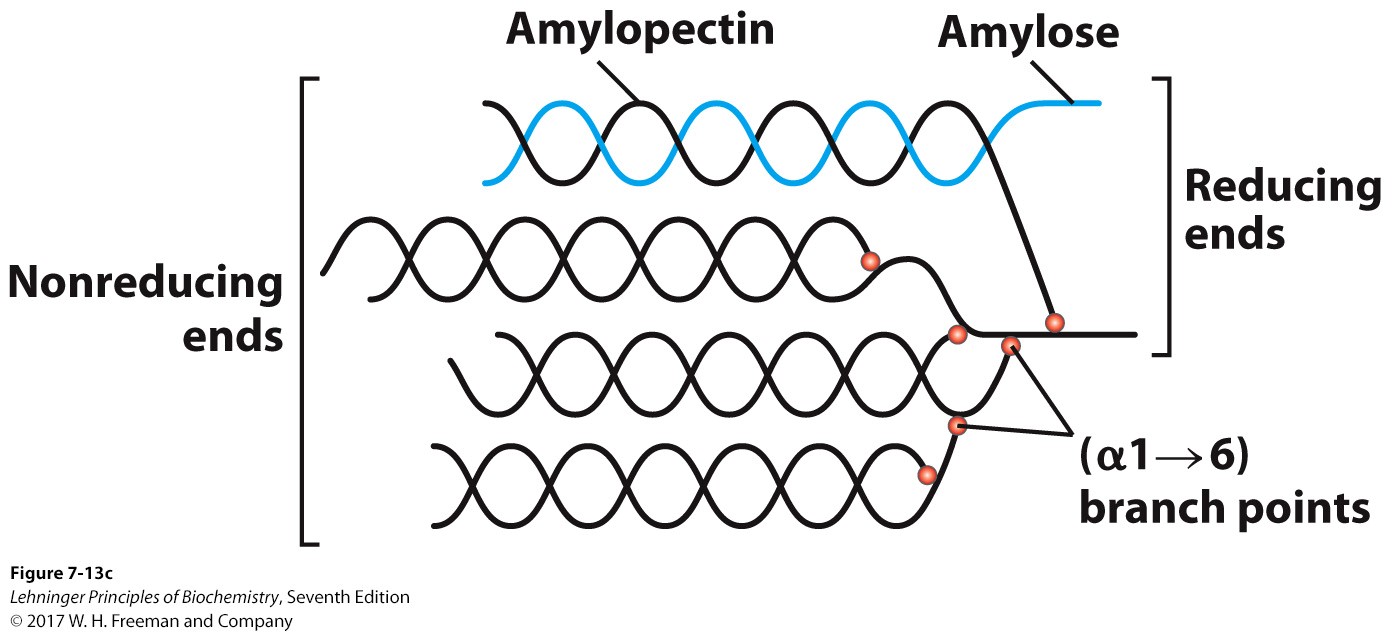
纤维素Cellulose: 一种线性同多糖
结构
- 葡萄糖β1->4糖苷键聚合而成
- 相邻两个单体之间会形成氢键,相邻两条链之间会形成氢键
- 结构坚固,不溶
代谢
- 大多数动物无法消化
- 真菌、细菌、反刍动物、白蚁等可以分泌纤维素酶来利用纤维素
甲壳素Chitin:一种线性同多糖
- N-乙酰-D-氨基葡萄糖β1->4糖苷键聚合而成
- 坚硬,不溶,在许多昆虫、蜘蛛、螃蟹、节肢动物中存在
琼脂糖Agar: 一种分支杂多糖
- 由琼脂糖agarose和琼脂胶组成
- 可形成凝胶用于培养细菌或DNA电泳
粘多糖/糖胺聚糖Glycosaminoglycans:重复的二糖单位聚合物
- 二糖单位中通常有一个是葡萄糖胺或半乳糖胺(含N)
- 通常因为羧基或磺酰基带负电
- 常见的透明质酸作为细胞外基质的主要成分,通过与细胞表面受体和结合分子之间的相互作用,在组织结构的建构和细胞增殖、迁移等细胞功能的调控中发挥着重要作用
- 肝素和硫酸乙酰化肝素,在抗凝血、调节血管形成、抗细菌病毒方面有重要作用
- 硫酸软骨素、硫酸角质素在关节处广泛存在
糖缀合物 Glycoconjugates
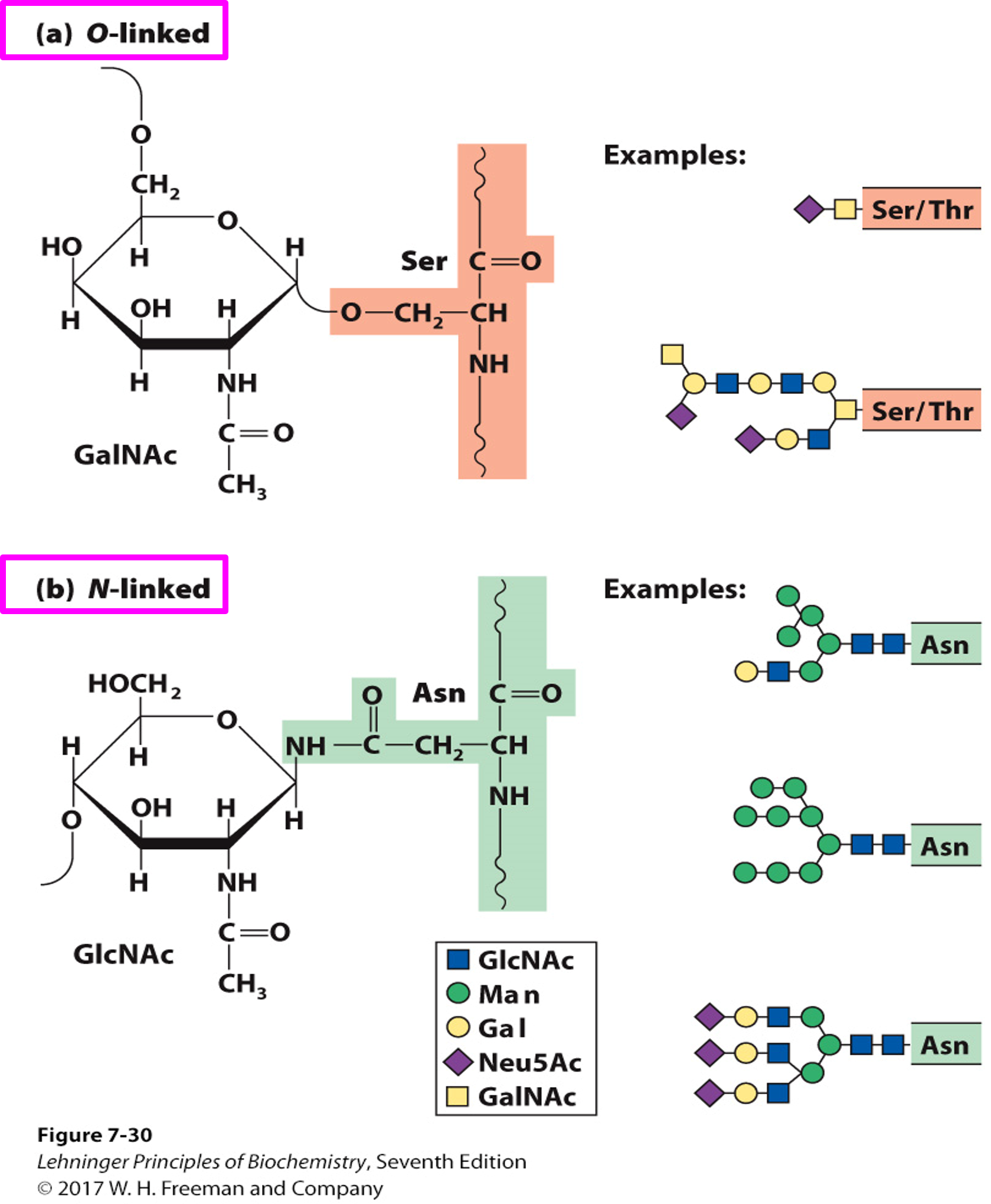
糖蛋白 Glycoprotein
- 连接有寡糖的蛋白质
- 糖的异头碳与氨基酸共价连接,通常是丝氨酸Ser、色氨酸Thr、天冬酰胺Asn
- 超过60%的哺乳动物蛋白是糖蛋白
- 少量细菌蛋白才会糖基化
病毒蛋白高度糖基化,帮助其免疫逃逸
两种连接方式:
- O连接:异头碳与丝氨酸和色氨酸的羟基氧连接
- N连接:异头碳与天冬酰胺的N连接
鞘糖脂 Glycosphingolipids
- 共价连接有寡糖的脂质
- 脊椎动物的神经节苷脂糖化方式决定血型
- 革兰氏阴性菌,有脂多糖覆盖在肽聚糖表面
蛋白聚糖 Proteoglycans
- 硫酸化的糖胺聚糖连接在细胞膜上的杆状的核心蛋白上
- 这些多糖侧链会先在末端引入一个含葡萄糖胺-半乳糖-半乳糖-木糖的连接部件,然后以此为桥梁让木糖与核心蛋白的丝氨酸羟基连接
- 透明质酸和蛋白聚糖形成巨大的聚合体。中心一条透明质酸,上面面接了很多蛋白聚糖的核心蛋白,这些核心蛋白又连接了一些糖胺聚糖(如硫酸角质素、硫酸软骨素),上面都带负电,彼此排斥,在水溶液中呈瓶刷状,这是非常光滑的材料,填充了关节接触面
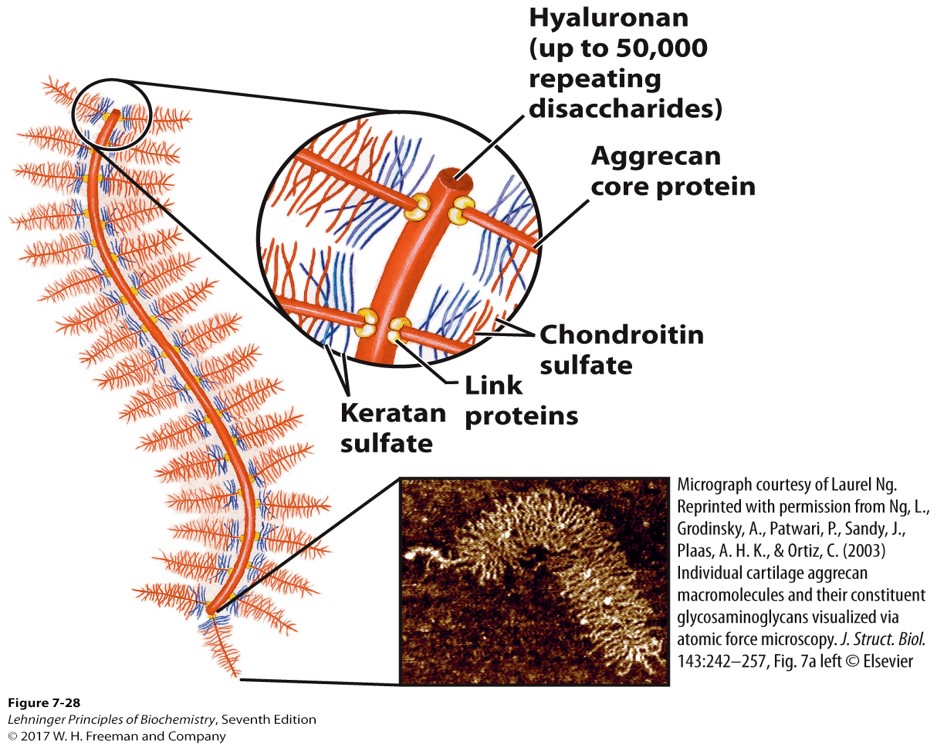
- 蛋白聚糖是细胞间质ECM的重要成分,对细胞生长、移动、分化、损伤修复有调节作用,还能防止肿瘤细胞逃逸
Chapter VIII Nucleotides and Nucleic Acids
核苷与核苷酸
- Nucleotide 核苷酸 = nitrogeneous base + pentose五碳糖 + phosphate
- Nucleoside 核苷 = nitrogeneous base + pentose五碳糖
磷酸基团
- 中性pH下带负电
- 通常与核苷的5号位相连,可以连1-3个(若与其他位置相连可能有特殊的作用)
核糖
- 含氧五元环,即呋喃糖
- RNA中是核糖;DNA中3号位脱氧,是脱氧核糖
含氮碱基
- 嘧啶为六元环,嘌呤为六元环并五元环
- 平面结构,有芳香性
- 嘧啶与嘌呤之间可以形成氢键
- Cytosine【胞嘧啶】, Adenine 【腺嘌呤】, Guanine【鸟嘌呤】 DNA与RNA均有
- Thymine 【胸腺嘧啶】DNA特有
- Uracil 【尿嘧啶】 RNA特有
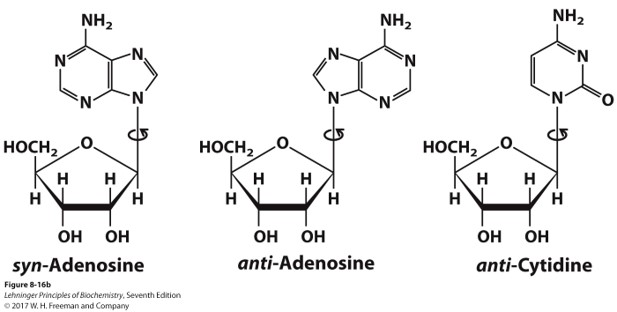
β-N-Glycosidic Bond(糖苷键)
- 核糖的2号位与嘧啶的1号位N、嘌呤的9号位N连接
- 朝上,均是β构象
- 非常稳定,不易水解
- 糖苷键可以旋转,嘧啶自然状况只有反式的,嘌呤都有,DNA中一般都是反式
核苷酸的检测
- 核苷酸在UV照射下有吸收峰,一般采用260纳米的的波长检测
少数核苷酸
- 主要是一些化学修饰
- DNA中:5-甲基胞苷,N6-甲基腺苷,5-羟甲基胞苷
- RNA中:次黄嘌呤核苷(肌苷)存在于一些tRNA的摆动区域;假尿嘧啶核苷 $\Psi$(糖苷键形成在$\Psi$的5号位C上)
多聚核苷酸 Polynucleotides
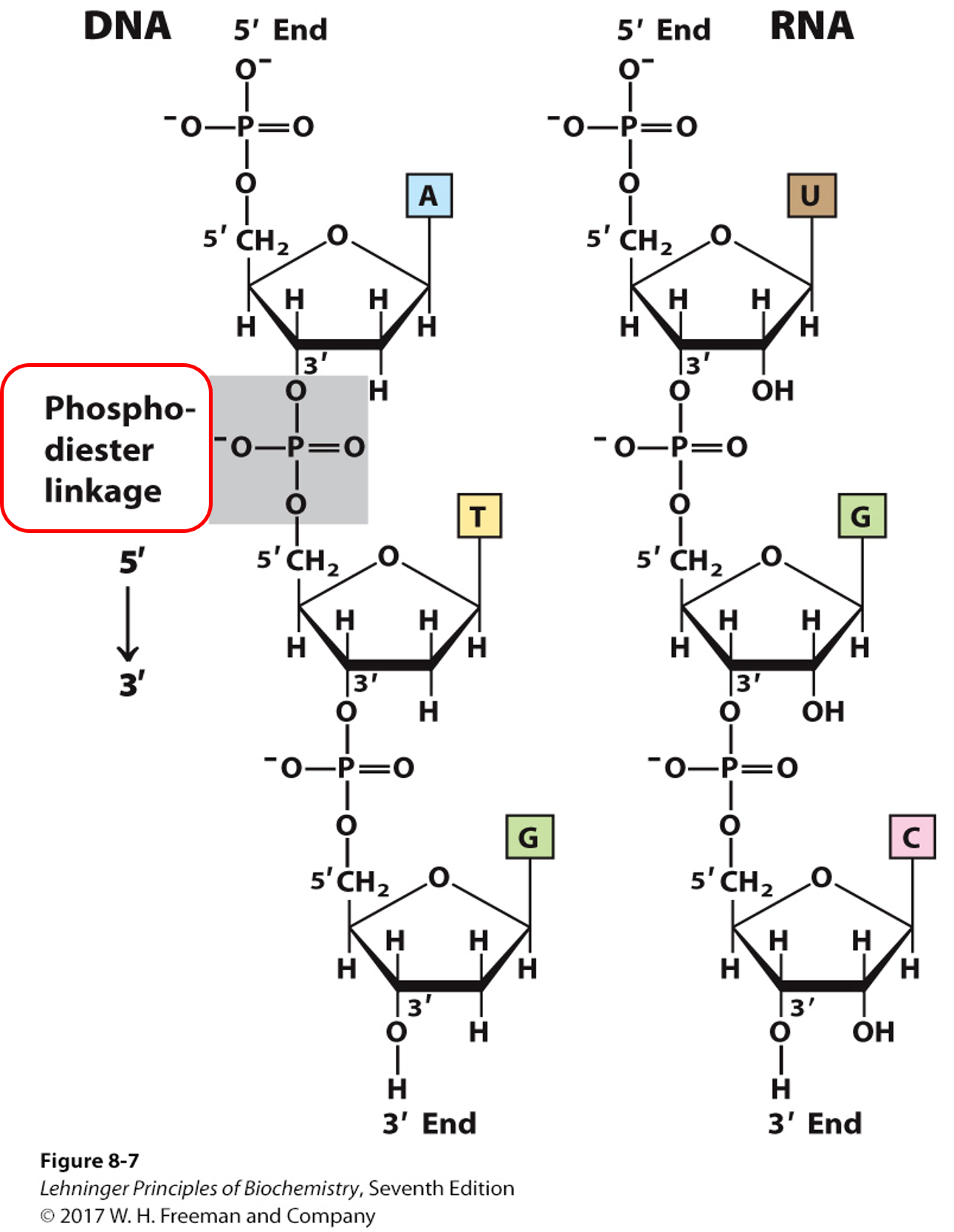
磷酸二酯键
碱基间氢键
- AT之间2个氢键,GC之间3个氢键
DNA (B构象)
- 发现: 沃森克里克,X射线晶体衍射
- 双螺旋结构:右手螺旋,每个螺旋3.6nm,即10.5个碱基对
- 其他的DNA构象:A构象(螺距2.6nm) Z构象(左手螺旋)
- DNA还可能形成三股(2嘧啶链+1嘌呤链)或四股螺旋
- 经典双链结构的两条链是互补配对、反向平行的
DNA 的变性 Denaturation
- 逆过程:退火 annealing
- 变性是破坏氢键而不是共价键,可通过温度或pH来变性
- 温度变性:$T_m$值为DNA50%变性的温度点,由pH、离子强度(高盐环境增加$T_m$值)、DNA长度(一定范围内与长度成正比)、碱基组成决定(一定范围内与GC含量成正比)
DNA突变 Mutagenesis
化学突变分子机制
- 脱氨基反应:最常见的C->U,虽然反应慢,但数量大,一个哺乳动物细胞中一天会发生100次
- 脱嘌呤反应:N-糖苷键被水解,一个哺乳动物细胞中一天会丢失10000个嘌呤
- 化学修饰:鸟嘌呤羟基化、甲基化,在线粒体DNA中最容易发生
- 细胞有纠正这些化学修饰的机制
辐射诱导突变分子机制
- UV射线诱导嘧啶二聚化(皮肤癌)
- X-Ray or $\gamma$-Ray 造成双螺旋解开、断裂
- 难以修复
RNA
mRNA
- 以DNA为模板合成的单链RNA
- 细菌的一条mRNA链可能编码了多个蛋白(多顺反子)
RNA的二级三级结构
- mRNA单链通常是右手螺旋
- 链内的回文序列可能可能形成发卡hairpin结构
- tRNA的二级结构是三叶草形,三级结构是倒L形
- 这些复杂结构主要由一些非典型的碱基配对造成
Chapter IX Lipids
脂质的生物学功能
- 储藏能量、保温、缓冲外力冲击、防水、为水生动物提供浮力与声学功能
- 组成生物膜、酶的辅因子、电子载体、细胞信号转导、光色素、抗氧化剂
- 依据功能,主要分为储能脂质(脂肪酸)、结构脂质(膜脂)、信号转导脂质(V-A,D,E,K)
脂肪酸 FA
结构
- 天然的脂肪酸大多是偶数个碳
- 大多数是无分支的
- 分为饱和Saturated、单不饱和Monounsaturated
、多不饱和Polyunsaturated 三类 不饱和键通常是顺式的 cis
在脊椎动物中,在血液循环中的自由脂肪酸由血清白蛋白运输,两者非共价交联(疏水相互作用)
Delta命名法
- 从末端羧基碳开始编号,定位不饱和键
- $18:3(\Delta 9,12,15)$表示共有17个碳,3个不饱和键,从羧基碳开始,第9,12,15号碳是不饱和的
物理性质
- 在水中的溶解度随着链的增长而降低
- 熔点随着链的增长而升高,随着双键数量增多而升高
- 不饱和脂肪酸有序度低,结构更松散,熔点比饱和脂肪酸低
反式脂肪酸 trans
- 由顺式的脂肪酸部分脱氢形成
- 排列更有序,因此具有更高的熔点和热稳定性
- 摄入反式脂肪酸会增加心血管疾病的风险
三酰甘油(又称甘油三酯) Triacylglycerol
主要性质
- 一种非极性分子
- 固体的叫脂肪fat ,液体的叫油oil
- 动物中脂质的主要储存形式
- 溶解度比脂肪酸低,密度比水小
结构
- 甘油骨架与三个脂肪酸形成酰键,三个脂肪酸可以是不同的
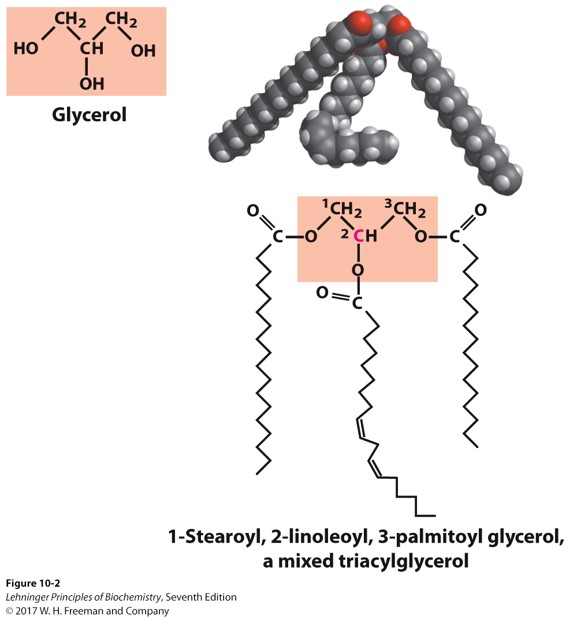
三酰甘油(脂肪、油)是高效的储能物质
- 和糖类相比更具有还原性,能携带更多能量
- 聚集在一起含水量小
糖原是短期储存快速递送,脂肪是长期储存缓慢递送
生物体中的存贮方式:
- 脊椎动物:储存在脂肪细胞中,同时包含了脂质酶,用于分解
- 植物种子:通常是液态的油,为种子萌发提供能量
生物蜡 Biological Waxes
生物蜡是长链醇与脂肪酸形成的脂(例如下图蜂蜡是棕榈酸+三十烷醇)
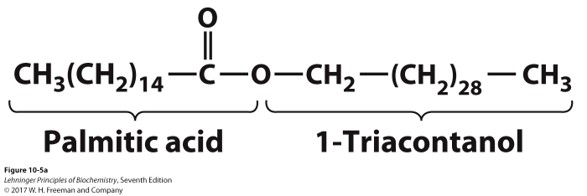
不溶、高熔点
- 可用作能量储存和防水剂,例如浮游生物就用生物蜡作为代谢燃料
生物膜中的脂质
- 极性头部+非极性尾部
- 骨架修饰、头部修饰、脂肪酸改变,导致了膜脂的多样性
- 不同器官、组织的膜有不同的头部基团成分
甘油磷脂 GP
膜的最主要成分
甘油的1号羟基通常连一个饱和脂肪酸,2号羟基通常连一个不饱和脂肪酸,3号羟基连接磷酸头部(头部还可以被进一步被X基团修饰)
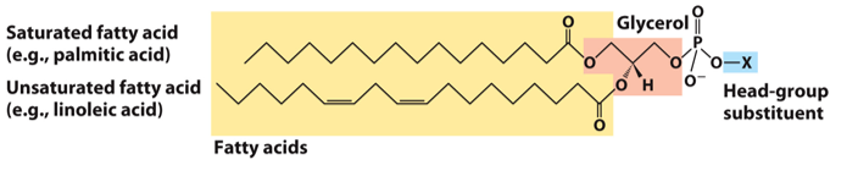
磷脂酰胆碱/卵磷脂:$X = (CH_2)_3N(CH_3)_3$,主要存在于真和生物细胞膜,大肠杆菌不能合成
- 磷脂酰乙醇胺/脑磷脂:$X = (CH_2)_3NH_3$
醚脂
- 基本骨架也是甘油,但是1号位是醚键,2号位一般是脂肪酸,3号位是磷脂
- 常见的有缩醛磷脂、血小板活化因子
鞘脂 SP
- 基本骨架是神经鞘氨醇
- 脂肪酸与鞘氨醇的氨基相连,形成酰胺键
- 疏水头部连接的是糖链时,形成鞘糖脂,常出现在细胞膜外表面,决定血型,糖链最末端没有是O型,最末端连乙酰半乳糖胺是A型,最末端连半乳糖是B型,两种都有是AB型
- 疏水头部连接磷酸胆碱时形成鞘磷脂,常出现在包裹神经细胞的髓鞘中
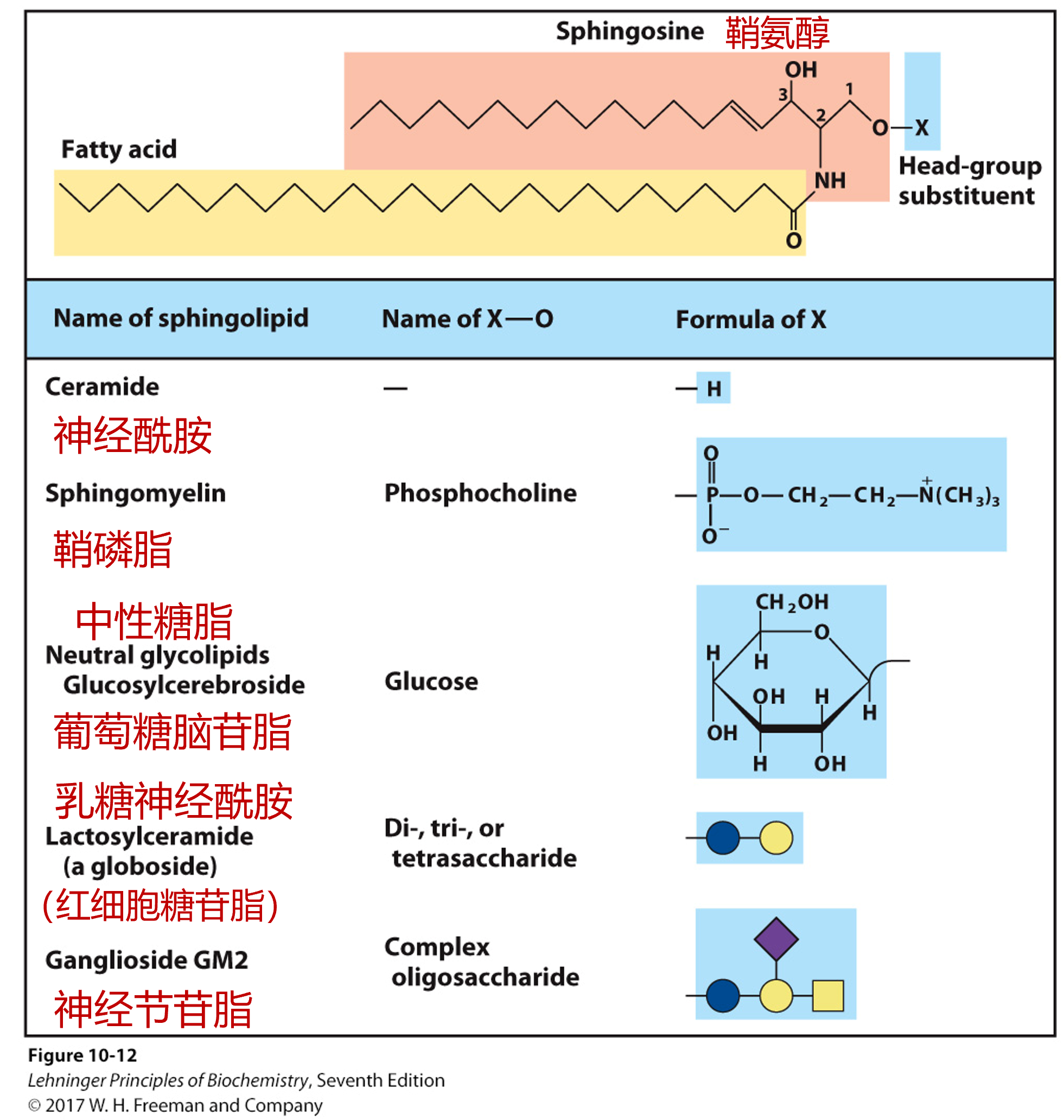
膜脂的降解
- 生物膜脂质是不断降解更替的
- 降解发生在溶酶体中,通过磷脂酶A-D完成,不同的酶切不同的键,最后完全水解呈组成这种膜脂的基本单位,如甘油、脂肪酸、磷酸、糖……
固醇 Sterols
结构
- 4个环组成甾核,几乎是平面的
- A环上有一个极性头部
- 有一条疏水链
(胆固醇的结构)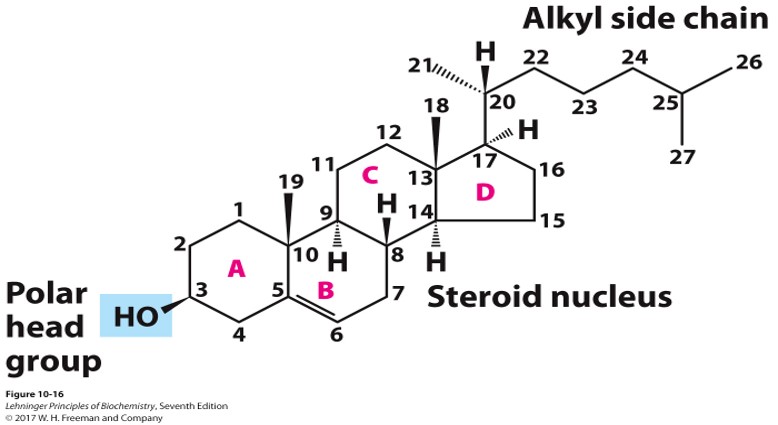
生理功能
- 调节膜的流动性和稳定性
- 加厚生物膜
- 不存在于细菌中
- 哺乳动物可以从食物中获取或在肝脏中从头合成
- 在血液中的运输需要通过蛋白质运载到组织
- 性激素、肾上腺皮质激素、糖皮质激素都是固醇
信号转导脂质
- 量少但功能重要
- 花生四烯酸及衍生物:前列腺素(炎症与发热)、血栓素、白细胞三烯(肺部平滑肌收缩)
- 维生素D:从胆固醇合成,需要在皮肤中接受紫外线,可用于调节钙质代谢
- 维生素A:又称视黄醇,β-胡萝卜素的衍生物,一种视色素
- 其他:V-E抗氧化剂,V-K凝血辅因子,线粒体电子载体(辅酶Q)、聚酮类(红霉素抗细菌,两性霉素B抗真菌、洛伐他汀是病毒抑制剂)
Chapter X Biological Membranes and Transport
脂质聚集形成的结构
- 分子从少到多,可以形成微团、脂双层、微囊
生物膜
基本概念
- 一种复杂的柔性脂质层,包含多种脂质和蛋白质
功能
- 物质转运
- 真核生物内细胞器膜可以区室化
- 信号转导,产生神经信号
- 通过质子浓度梯度储存能量
- 合成ATP
主要特点
- 主要由两层的磷脂分子构成(除了一些古菌是单层的)
- 在水溶液中能自发形成
- 具有不对称性:两层的组成不同,外层更多正电;外层含有的磷脂酰丝氨酸PS有重要的作用(凝血、标记需要凋亡的细胞)
组成
- 主要是三种甘油磷脂卵磷脂PC、磷脂酰丝氨酸PS和脑磷脂PE + 一种鞘磷脂
- 每种膜都有独特的脂质和蛋白质组成,不同细胞器、细胞、组织的膜成分都不同
- 线粒体和原核生物的膜没有固醇,植物叶绿体富含半乳糖脂但动物几乎没有
膜运输
- 生物膜不是静态的,通过囊泡运输来完成,从内质网运到高尔基体,再运到细胞膜或溶酶体
膜蛋白
主要功能
- 受体:感知外界信号
- 通道、门、泵:运输物质
- 酶:催化合成
主要类型
- 外周膜蛋白:与膜脂的极性头部非共价相互作用,松散连接,可以通过高盐或pH改变被去除
- 兼在膜蛋白:通过某种特定的生物调控信号被磷脂或糖脂共价锚定,可逆去除
- 膜内常见的是蛋白法尼基化锚定,该类蛋白有一个特征序列CaaX, C是半胱氨酸,a是有脂肪链的氨基酸,X是甲硫、丝、谷或丙氨酸,需要法尼基转移酶参与
- 膜外常见的是GPI锚定,即糖基磷脂酰肌醇
- 内在膜蛋白:嵌在膜里面,有疏水区和亲水区,连接紧密
膜蛋白的构象
- 氨基酸的分布:带电氨基酸分布在亲水端,Tyr酪氨酸和Trp色氨酸分布在亲水疏水界面,膜内部分主要是有脂肪链的氨基酸
- 三维构象:常见的是β折叠形成的β桶
膜的物理性质
- 动态、灵活性好
- 多相、可以发生相变
- 半透性,且透过性可被人为改变
膜的物理相
- 低于生理温度:有序液态(类晶态/凝胶态)
- 高于生理温度:无序液态(液晶态)
- 温度是引起相变的主要因素
机体可以调节膜的组成来改变物理性质
- 膜的流动性主要由脂肪酸组成和熔点决定
- 适应高温:更多长链、饱和脂肪酸,流动性差
- 适应低温:更多短链、不饱和脂肪酸,流动性好
- 固醇可以增加膜的刚性和渗透性
膜的动态变化
侧向扩散:无需催化、非常快(1μm/s)、单个的脂质分子或蛋白质在单层上位移
- 研究方法:FRAP光漂白荧光恢复法——标记荧光探针,用激光漂白,一段时间后测量漂白区域又出现了多少荧光,这些荧光来自于未漂白区域的扩散
翻转扩散:需要催化、非常慢、从一层膜转移到另一层膜
- 翻转酶:将外层磷脂转入内层,消耗ATP
- 转出酶:内层转到外层,消耗ATP
- 促翻转酶:双向,不用ATP
膜筏 Membrane Rafts
- 富含胆固醇和鞘脂类的区域,更加有序
- 固定了许多特定的双或三酰基化蛋白质,使得膜蛋白能够功能分区
- 一类常见的膜筏会在膜上形成一个凹陷的小窝,由小窝蛋白caveolin二聚体固定
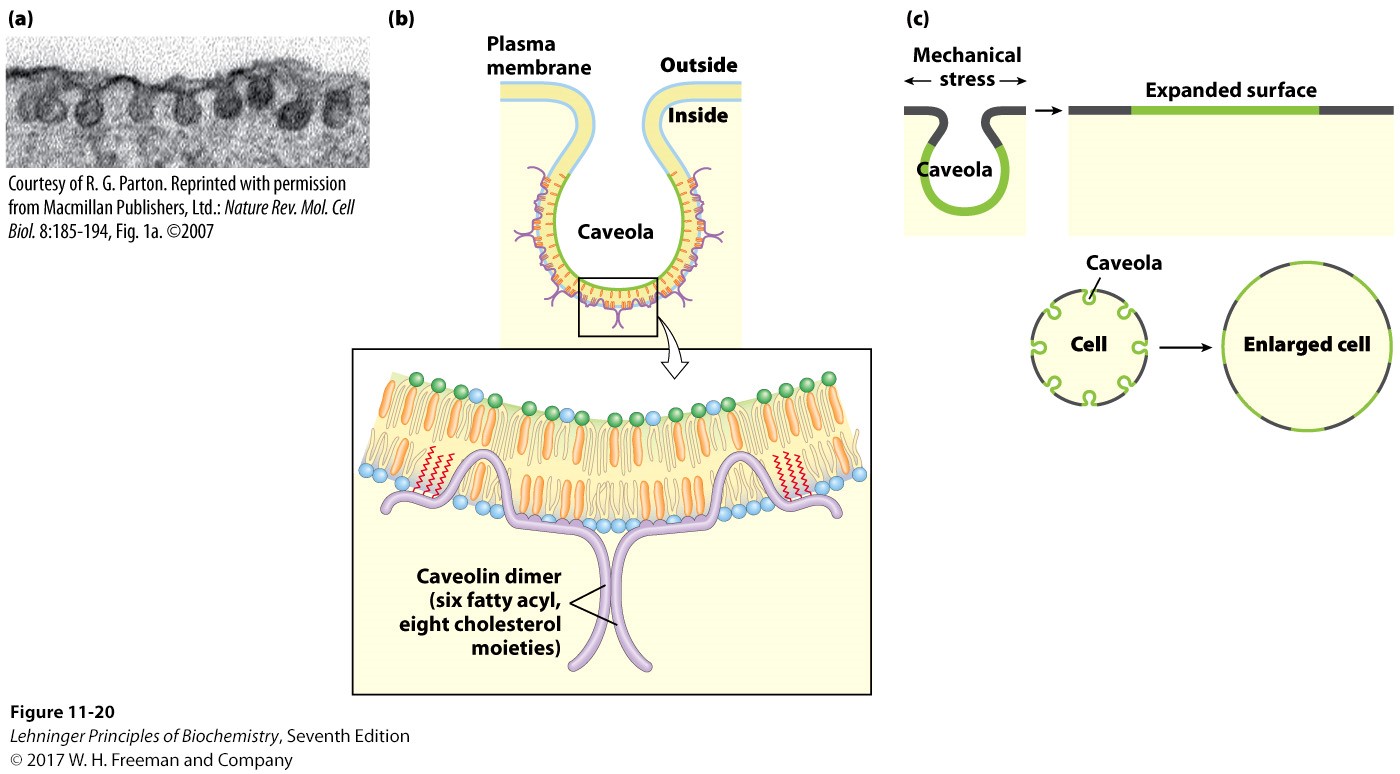
- 有融合蛋白的膜筏是膜融合的关键:膜融合经历了识别、接近、扭曲膜结构形成半融合、完成融合(神经递质的释放)
跨膜运输
膜转运蛋白
- 载体蛋白tranporter:
- 通过构象改变使溶质分子穿过细胞膜
- 既可介导被动运输,也可介导主动运输
- 结构是双门,交替开门,又称离子泵
- 转运速度较慢,有最大速率
- 通道蛋白channel:
- 中间形成亲水性通道,转运特定的溶质
- 只能被动转运
- 结构是单门,开放即可转运物质,关闭就不转运,依据门的开关调控可以分为电压门(膜电压改变,引起带电蛋白质构象改变,从而开关门)和配体门(和信号分子结合或移除,结构改变,从而开关门)
- 转运速度极快,通常是载体蛋白的成百上千倍,无最大速率,不会被饱和
- 转运方向
- 单向转运
- 协同转运:又分为同向转运(两个物质流向相同)和反向转运(两个物质流向相反)
被动运输
简单扩散:顺浓度梯度,直接透过磷脂层【氧气、二氧化碳、氮气、水、尿素、甘油等小分子】
协助扩散:又称易化扩散,顺浓度梯度,需要蛋白协助
- 载体蛋白tranporter介导:
实例1:葡萄糖转运蛋白GLUT1/2,单向转运,12个两性α螺旋组成一个桶,中心亲水,外周疏水。上端开口时葡萄糖进入,沿疏水通道向下,下端开口时向胞内释放,如小肠上皮细胞将葡萄糖转入血液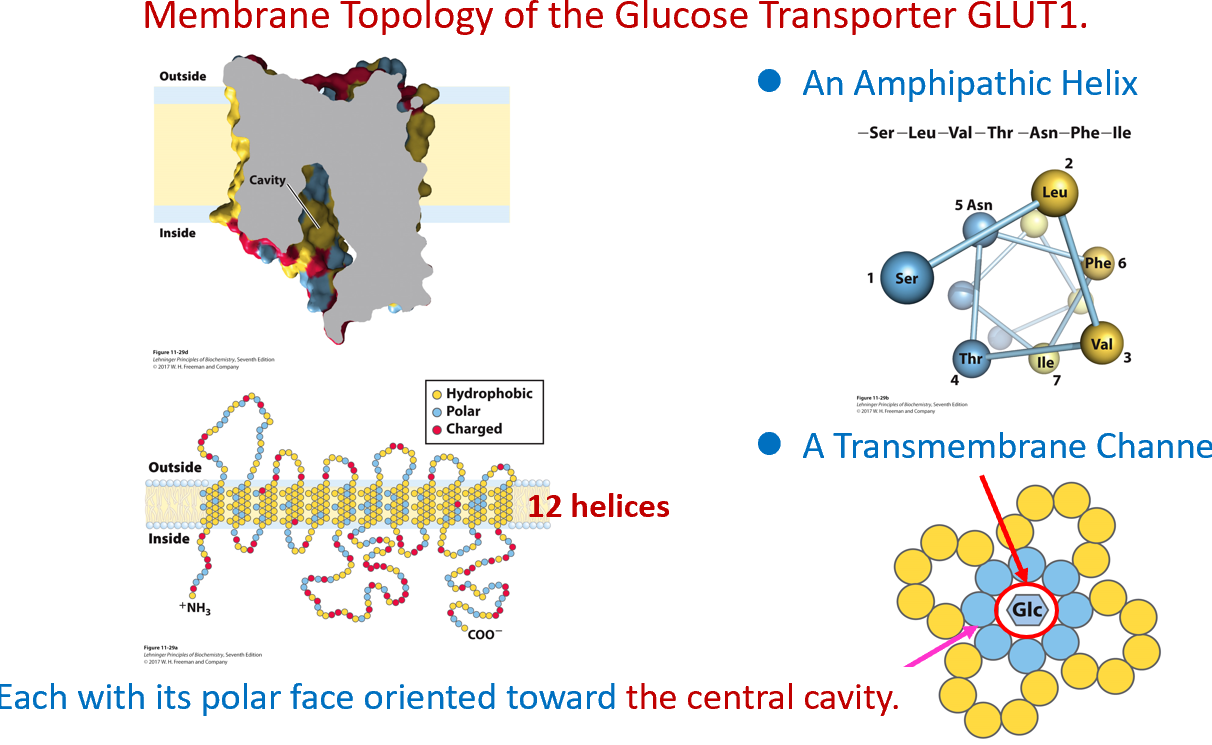
- 通道蛋白channel介导:
实例3:水通道蛋白AQPs,中心孔径只允许水通过,通道中的天冬酰胺Asn带正电,排除质子通过,AQP7能使甘油通过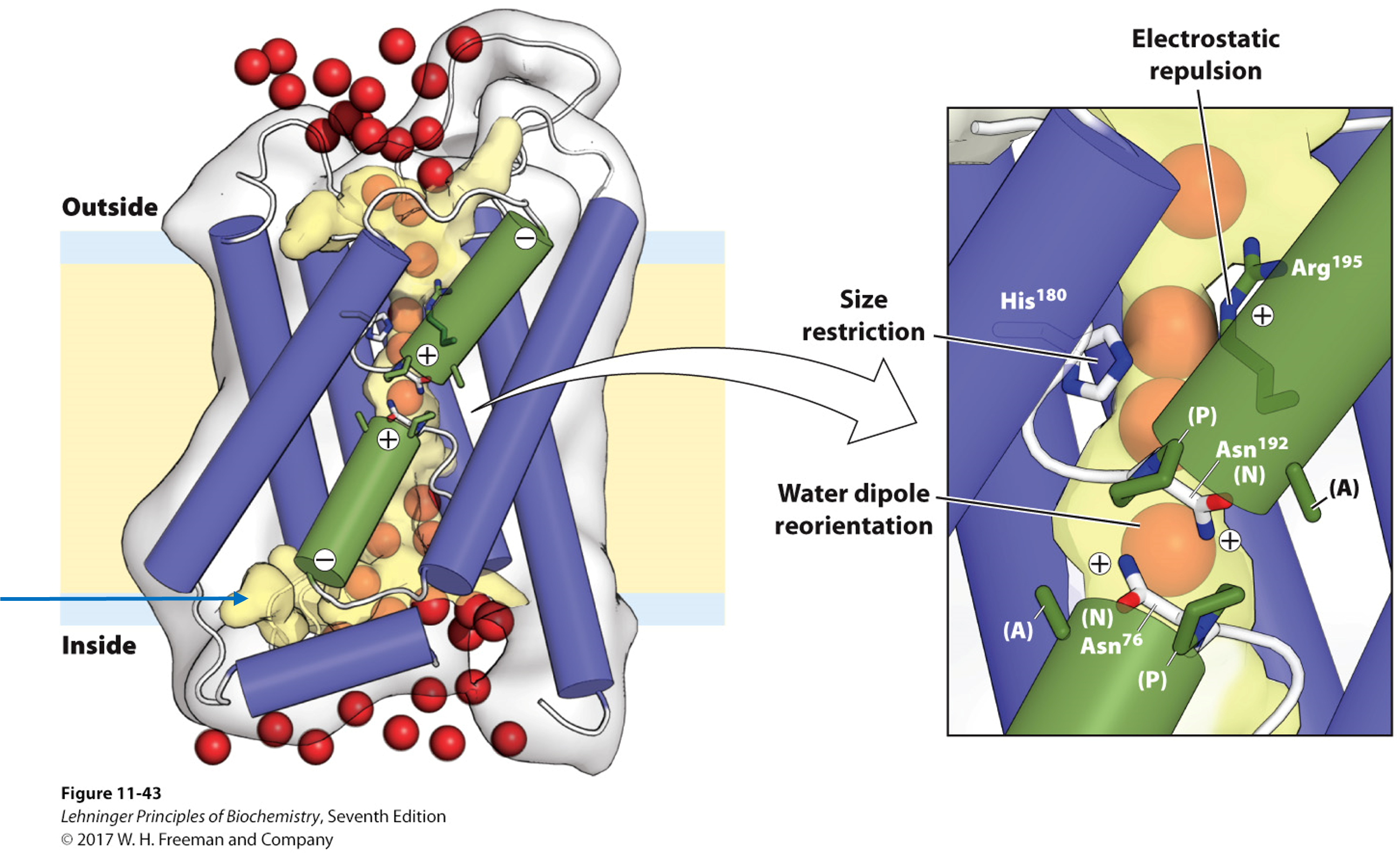
- 载体蛋白tranporter介导:
主动运输
ATP驱动泵:直接利用水解ATP提供的能量
- P型泵:自身被磷酸化,引起构象改变,运输阳离子,如钠钾泵(排3钠入2钾)
- V型质子泵:不能被磷酸化,单向,存在于溶酶体膜、液泡膜上,将氢离子泵入细胞器,保持内部酸性
- F型质子泵:不能被被磷酸化,双向,存在于线粒体内膜、类囊体膜、细菌质膜上,既可以水解ATP泵入质子,也可以用质子浓度梯度合成ATP
- ABC转运蛋白超家族:主要转运小分子或阴离子,人类的氯离子转运蛋白CRTF就是一种ABC转运蛋白,异常会导致囊性纤维化
协同转运蛋白:间接消耗能量,即消耗用ATP水解能量建立起来的一种离子的电化学梯度来转运另外一种物质
- 实例1:小肠上皮细胞吸收葡萄糖,钠离子—葡萄糖同向转运,用钠离子的浓度梯度驱动,两个钠离子转运一个葡萄糖,从肠道中吸收葡萄糖到胞内
- 实例2:碳酸氢盐转运,氯离子-碳酸氢盐反向转运,肺部组织从血液转入碳酸氢根离子,转出氯离子,再转化成二氧化碳排出体外;肌肉组织相反,将二氧化碳转化为碳酸氢盐,转入血液
Chapter XI Biosignaling
信号转导的方式与特点
四种主要的信号转导机制
- G蛋白偶联信号通路
- 酶联受体
- 门控离子通道
- 结合固醇并改变基因表达的核受体
信号转导的基本过程
- 信号与受体互作用
- 被激活的受体产生次级信号或改变细胞内蛋白的活动
- 细胞的代谢活动发生改变
- 信号转导事件终止
信号转导的六大特点
- 专一性Specificity:信号分子与受体蛋白互补,特异性地结合
- 放大作用Amplification:非常灵敏,只要一个信号激活一个受体,再激活多个二级信号,层层放大,指数级增长
- 模块性Modularity:一种信号蛋白通常有多个结构域,不同的模块可以完成不同的信号转导过程
- 脱敏作用Desensitization:当一个信号持续作用时,系统会脱敏,不再响应,刺激水平下降后,又会恢复敏感性
- 整合作用Integration:多个信号通路同时发生,最后整合为一个净结果
- 局部反应Localized Response:一个信号只对局部的区域(如一个膜筏)起作用,不会扩散到更远的区域
G蛋白偶联信号通路
G蛋白偶联受体GPCRs
- 一种有α螺旋的跨膜蛋白,接受外界信号
G蛋白
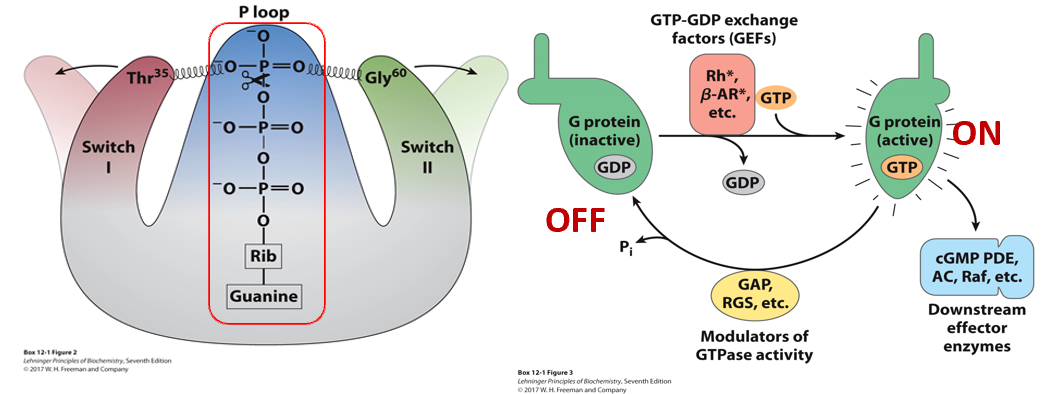
- 一种异源三聚体αβγ,与受体蛋白结合
- α亚基有三个功能位点:GTP结合位点、GTP水解活性位点、ADP-核糖化位点
- 结合GDP时无活性,结合GTP时有活性
- G蛋白的$Thr^{35}$苏氨酸和$Gly^{60}$丙氨酸与GTP的第三个磷酸形成氢键,当GTP被水解为GDP时,两条臂释放,不再能与下游目标作用
许多因子调节G蛋白的活动
- G蛋白的激活需要GTP-GDP交换因子(不是合成一个GTP,而是置换反应)
- G蛋白的GTP水解活性位点正常情况下活性很弱,需要激活蛋白GAP,RGS等激活,才能水解GTP
二级信使
- cAMP(AC途径) :ATP脱去两个磷酸基团后3号位和5号位环化,可以激活PKA
- $IP_3$ + 二酰基甘油(PLC途径):这两个物质由$PIP_2$分 解形成,可以激活PKC或钙调蛋白
几种常见G蛋白偶联受体信号通路
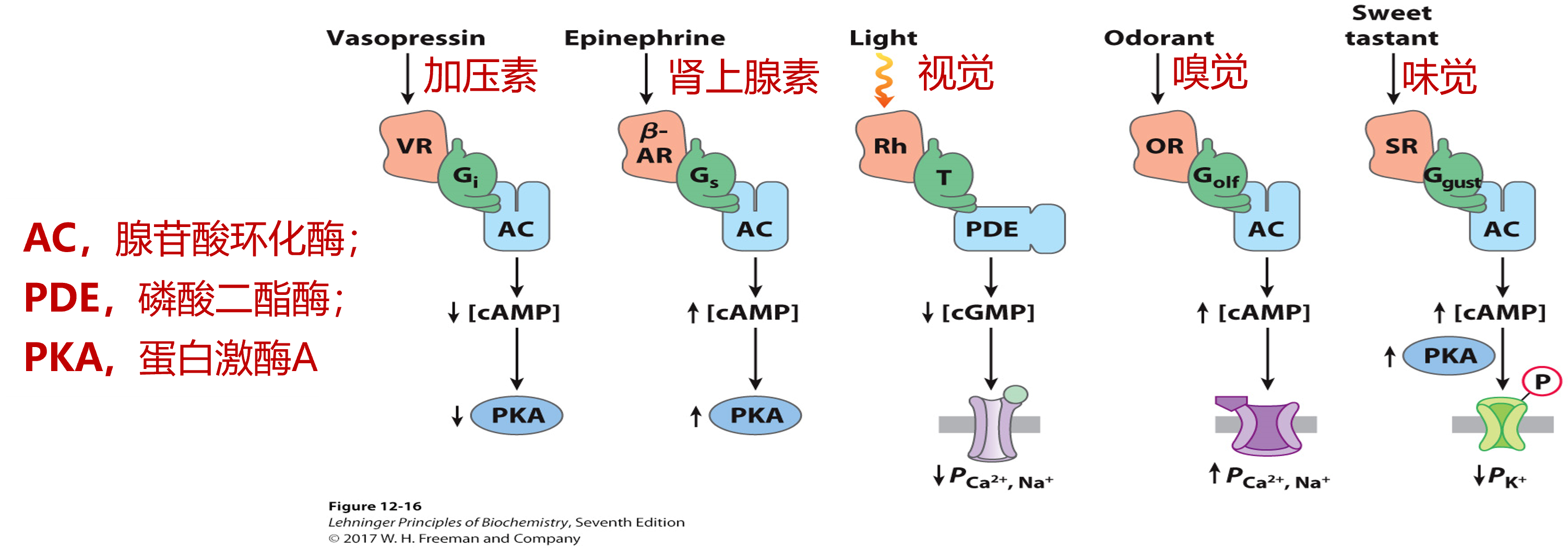
汇总
酶联受体信号通路
酶联受体的特点
- 通常有两个结构域:膜外配体连接区、膜内催化区
- 常见的催化活性区域有酪氨酸激酶活性或鸟苷酸环化酶活性
鸟苷酸环化酶活性酶联受体 (RGC)
- 将GTP脱去两个磷酸基团后3号位和5号位环化形成cGMP(二级信使),可以激活PKG
- PKG可以磷酸化靶蛋白的丝氨酸Ser和苏氨酸Thr
- 两种类型的GC:
- 跨膜的GC:鸟苷素和内毒素受体
- 可溶性含血红素的NO激活型GC:在心肌中,NO与GC的血红素基团结合,使GC催化产生cGMP,激活PKG,促进肌肉舒张,所以NO可以治疗心绞痛;在阴茎中,同样的过程会促进血管舒张,增大血流量,促进勃起,药物西地那非(伟哥)可以抑制cGMP水解酶PDE的活性,使得cGMP含量持续升高,从而治疗勃起功能障碍。
酪氨酸激酶活性酶联受体 (RTK)
- 一般都是跨膜蛋白
- 膜外部分与信号分子结合后,膜内催化区域自磷酸化 Auto-phosphorylation
- 构象改变,允许靶蛋白的结合,并磷酸化靶蛋白的酪氨酸Tyr
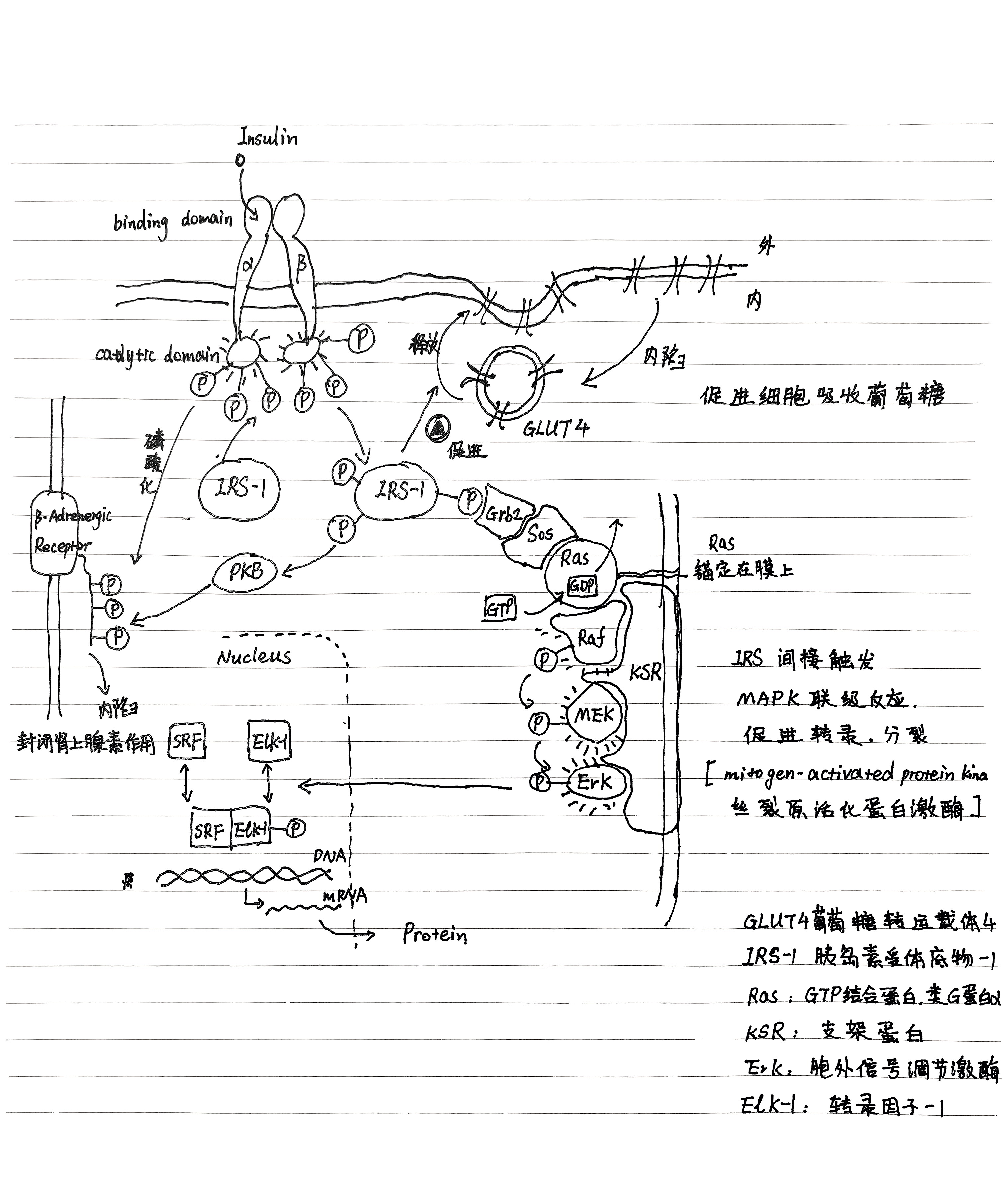
- 实例:胰岛素(Insulin)作用过程